EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
EMBO Molecular Medicine
La acumulación de la proteína Versicano es responsable de los aneurismas de aorta del síndrome de Marfan
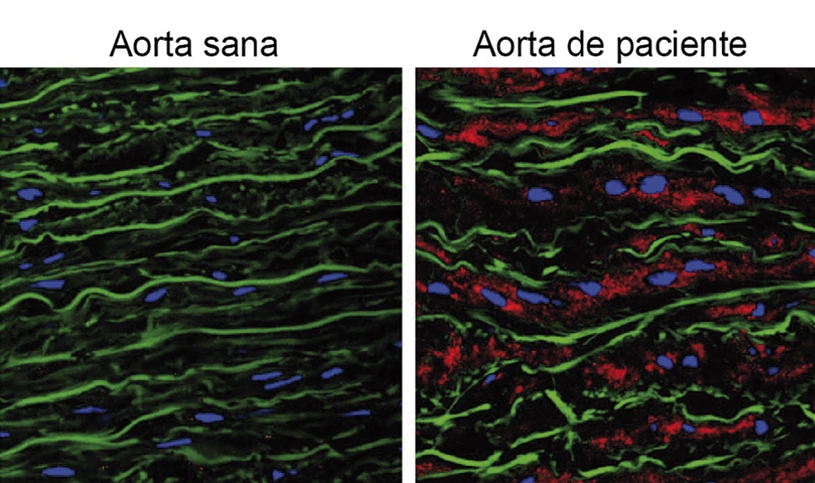
Investigadores del CNIC, en colaboración con el Centro de Biología Molecular Severo Ochoa (CBMSO), han identificado una de las causas subyacentes de los aneurismas aórticos en el síndrome de Marfan, un trastorno genético grave que afecta al tejido conectivo y para el cual no existen tratamientos farmacológicos efectivos. El estudio, publicado en EMBO Molecular Medicine, fue liderado por Juan Miguel Redondo y Miguel R. Campanero del CBMSO, con la participación de equipos del CIBERCV y hospitales como el Vall d’Hebron y el Marqués de Valdecilla.
Los investigadores descubrieron que los niveles del proteoglicano Versicano, una proteína clave del espacio extracelular, están significativamente aumentados en la aorta de pacientes con síndrome de Marfan y en modelos animales de la enfermedad. Este aumento del Versicano fue vinculado directamente con la formación de aneurismas aórticos, lo que lo señala como un factor crucial en la patología aórtica de esta enfermedad.
Además, el estudio reveló que la ruta de señalización mediada por la proteína AKT, que ya se había relacionado con otras enfermedades aórticas, juega un papel importante en la progresión de los aneurismas en el síndrome de Marfan. Los experimentos mostraron que la inhibición farmacológica de AKT reduce la expresión de la proteína Nos2, productora de óxido nítrico, y revierte la dilatación aórtica en ratones Marfan. También se observó que la ruta de AKT está activada en las aortas de pacientes humanos con esta enfermedad.
Este descubrimiento abre nuevas perspectivas terapéuticas, ya que podría permitir el desarrollo de tratamientos específicos para prevenir o retardar la progresión de los aneurismas aórticos en pacientes con síndrome de Marfan.
El estudio ha contado con ayudas de la Fundación Marfan de EEUU; la Fundación MERCK-Fundación Española de Enfermedades Raras 2022 y las Ayudas V “Muévete por los que no pueden 2021”, así como los contratos del Ministerio de Ciencia e Innovación de España FPI.
Science Advances
Primera diana terapéutica para salvar la función cardíaca en pacientes con hipertensión pulmonar

Un equipo de investigadores liderado por la Dra. Guadalupe Sabio en el CNIC ha realizado un avance significativo en la búsqueda de tratamientos para la hipertensión pulmonar, una enfermedad rara y letal que hasta ahora carece de una cura efectiva. El estudio, publicado en la revista Science Advances, ha identificado una diana terapéutica potencial que podría preservar la función cardíaca en pacientes afectados por esta enfermedad.
La hipertensión pulmonar se caracteriza por una elevada presión en las arterias que transportan sangre a los pulmones, lo que obliga al corazón a trabajar con mayor intensidad de forma constante. Afecta entre 15 y 50 personas por millón de habitantes, provoca síntomas severos como dificultad para respirar, mareos, desmayos y, en casos graves, puede requerir un trasplante para evitar la muerte.
Los tratamientos actuales están orientados a reducir la presión arterial en los pulmones, pero no abordan eficazmente el problema del fallo cardíaco, que es la principal causa de muerte en estos pacientes.
El equipo del CNIC, al estudiar modelos animales, descubrió que los niveles de la proteína mitocondrial MCJ eran más altos en pacientes con EPOC, ratones expuestos a bajos niveles de oxígeno, y cerdos con daño cardíaco. Estos hallazgos llevaron a considerar que la proteína MCJ podría estar implicada en la hipertensión pulmonar.
Los resultados muestran que al modular los niveles de la proteína MCJ en el corazón, se puede mantener la función cardíaca a pesar del daño pulmonar. Esta protección parece estar relacionada con la activación de una vía de señalización que ayuda al corazón a adaptarse a la falta de oxígeno, preparando al órgano para seguir funcionando adecuadamente en condiciones adversas. Este estudio fue financiado por el Ministerio de Ciencia e Innovación (RED2022-134397-T, MINECO-PID2019-104399RB-I00, PGC2018-097019-B-I00), el proyecto IMPACT-2021 (PMP21/00057), la Fundación Jesús Serra, EFSD/Lilly European Diabetes Research Programme, la Fundación BBVA, la Comunidad de Madrid y la AECC.
Circulation Research
Las variantes genéticas de la APOE, implicadas en alzhéimer, también se asocian con el desarrollo de aterosclerosis subclínica

Investigadores del CNIC han descubierto que el gen APOE4, conocido por ser un fuerte factor de riesgo para el alzhéimer de inicio tardío, también está asociado con un mayor riesgo de desarrollar aterosclerosis subclínica en la mediana edad. Este hallazgo, publicado en Circulation Research, revela que, en contraste, la variante APOE2 ofrece protección tanto contra el alzhéimer como contra la aterosclerosis.
El gen APOE codifica la apolipoproteína E, que ayuda a transportar lípidos en la sangre y tiene tres variantes principales: APOE2, APOE3 y APOE4. Las personas con APOE4 tienen niveles más altos de colesterol LDL y mayor riesgo de aterosclerosis, mientras que aquellas con APOE2 tienen niveles más bajos de colesterol y están más protegidas frente a esta enfermedad cardiovascular.
El estudio PESA-CNIC-Santander, que evaluó a individuos de mediana edad, confirmó que los portadores de APOE4 tienen un mayor riesgo de aterosclerosis subclínica debido a sus altos niveles de colesterol LDL. En cambio, los portadores de APOE2 mostraron menos aterosclerosis, especialmente en arterias carótidas, femorales y coronarias, lo que podría atribuirse a niveles normales de triglicéridos y menores niveles de colesterol en mujeres y personas más jóvenes.
Los investigadores también encontraron que en hombres y personas mayores con APOE2, la protección contra la aterosclerosis podría estar relacionada con mecanismos antiinflamatorios y una menor activación del sistema inmune. Este descubrimiento resalta la importancia de considerar la isoforma de APOE presente en cada individuo para mejorar la evaluación del riesgo cardiovascular, especialmente en las etapas iniciales de la enfermedad.
Este estudio fue financiado por el Fondo Europeo de Desarrollo Regional (FEDER–Una manera de construir Europa) y el Fondo Social Europeo (FSE–Invertir en tu Futuro).
El estudio PESA está cofinanciado a partes iguales por CNIC y Banco Santander. Además, recibe financiación del ISCIII (PI15/02019, PI17/00590 & PI20/00819) y para este estudio en particular también ha recibido financiación de la Fundación BrightFocus. En el estudio han participado investigadores del CIBER de Enfermedades Cardiovasculares (CiberCV) y del CIBER de Enfermedades Raras (CiberRER).
Nature Cardiovascular Research
Hallan una vía para diseñar terapias que potencien el efecto de los fármacos que reducen el colesterol

Un equipo del CNIC y la Universidad de Aarhus ha descubierto un mecanismo clave que podría ayudar a reducir las placas ateroscleróticas, centrándose en células derivadas del músculo liso como una nueva diana terapéutica. El estudio, publicado en Nature Cardiovascular Research, muestra que un tipo específico de señalización inflamatoria en estas células contribuye al crecimiento de las placas, y su control podría mejorar la eficacia de los tratamientos actuales.
Durante la aterosclerosis, las células del músculo liso que forman las paredes arteriales se transforman y proliferan, contribuyendo al desarrollo de enfermedades cardiovasculares. El estudio demuestra que al reducir el colesterol en modelos de aterosclerosis avanzada, disminuye un subgrupo de estas células que promueve el crecimiento de las placas, mientras se mantienen las células que ayudan a estabilizarlas.
Estos hallazgos sugieren que dirigir terapias a estos subtipos celulares podría ser clave para revertir la aterosclerosis en etapas avanzadas. La investigación ha sido posible gracias a avanzadas herramientas técnicas y un fuerte trabajo en equipo, permitiendo un análisis detallado del comportamiento de estas células en la aterosclerosis.
La investigación ha sido financiada por el Consejo Europeo de Investigación (No 866240, JFB), el Ministerio de Ciencia e Innovación (PID2019-108568RB-I00, JFB) y la Fundación Novo Nordisk en Dinamarca (NNF17OC0030688, JFB).
Circulation Research
Descubren un nuevo mecanismo de arritmias potencialmente letales en el síndrome Andersen-Tawil

Un equipo del CNIC, liderado por el Dr. José Jalife, ha realizado un avance significativo en la comprensión de las arritmias cardíacas, especialmente en relación con el síndrome de Andersen-Tawil (ATS), una rara enfermedad hereditaria. El estudio revela que una mutación en el canal de potasio Kir2.1 (C122Y) no solo afecta a este canal, sino también al canal de sodio NaV1.5, lo que desencadena arritmias potencialmente mortales. Este hallazgo, publicado en Circulation Research, demuestra que la mutación desestabiliza la función de ambos canales, esenciales para mantener un ritmo cardíaco estable.
Utilizando un modelo de ratón que replica las irregularidades eléctricas del ATS1, los investigadores descubrieron que la mutación altera tanto el Kir2.1 como la estabilidad y expresión del NaV1.5, reduciendo su función y aumentando el riesgo de arritmias. Este descubrimiento abre la puerta a tratamientos personalizados para el ATS1 y otras enfermedades cardíacas, subrayando que los mecanismos moleculares varían según la mutación específica.
Este estudio ha sido financiado por el Instituto Nacional del Corazón, los Pulmones y la Sangre de los NIH USA; la Fundación ‘la Caixa; Fundación La Marató de TV3; CIBERCV; Programa Horizon 2020 de la Unión Europea, y Programa S2022/BMD7229. Los estudios de imagen se realizaron en el nodo TRIMA@CNIC de la ICTS ReDIB.
JACC: CardioOncology
Identifican dianas terapéuticas para prevenir el daño cardiaco asociado a una terapia para el cáncer

Investigadores del CNIC han revelado los mecanismos por los cuales las antraciclinas, un grupo de fármacos ampliamente utilizados en el tratamiento del cáncer, provocan daño cardíaco en los pacientes. Este hallazgo es crucial, ya que se estima que un tercio de los pacientes tratados con antraciclinas desarrolla algún grado de toxicidad cardiaca, y en más del 5% de los sobrevivientes de cáncer, este daño es irreversible, llevando a insuficiencia cardíaca crónica, lo que afecta gravemente su calidad de vida.
El estudio, publicado en la revista JACC: CardioOncology, muestra cómo las antraciclinas alteran el metabolismo del corazón, afectando especialmente a las mitocondrias, que son las “centrales energéticas” de las células cardíacas. Estas alteraciones en el metabolismo se manifiestan muy temprano en el tratamiento, incluso antes de que el corazón muestre una pérdida significativa de fuerza contráctil. Según el Dr. Borja Ibáñez, director del estudio, las antraciclinas interfieren con el transporte de combustibles esenciales como los ácidos grasos y la glucosa, lo que resulta en una disfunción irreversible de la producción energética por parte de las mitocondrias, y conduce a la atrofia precoz del músculo cardíaco.
El equipo del CNIC también ha identificado posibles intervenciones para mitigar este daño, entre ellas, un enfoque nutricional basado en una dieta hiperproteica que podría prevenir la atrofia cardiaca causada por las antraciclinas. Este enfoque innovador ya está siendo probado en modelos experimentales, y si los resultados preliminares son positivos, podría dar lugar a un ensayo clínico para validar su eficacia en pacientes.
El grupo de investigación liderado por el Dr. Ibáñez coordina proyectos financiados por la comisión europea (ERC-Consolidator “MATRIX”, y Horizon2020-HEALTH “RESILIENCE”) que tienen como objetivo reducir la prevalencia de insuficiencia cardiaca en supervivientes del cáncer. Mostrando la visión traslacional y multidisciplinar, estos proyectos se realizan en colaboración entre el CNIC, el Hospital Universitario Fundación Jiménez Díaz y el CIBERCV.
Este estudio ha sido financiado por la Comisión Europea (ERC-CoG 819775 y H2020-HEALTH 945118), el Ministerio de Ciencia, Innovación y Universidades de España (PID2022-140176OB-I00), y la Comunidad de Madrid a través de la Red Madrileña de Nanomedicina en Imagen Molecular (P2022/BMD-7403 RENIM-CM).
JACC
Un estudio identifica por primera vez el riesgo de miocardiopatía dilatada en los portadores genéticos
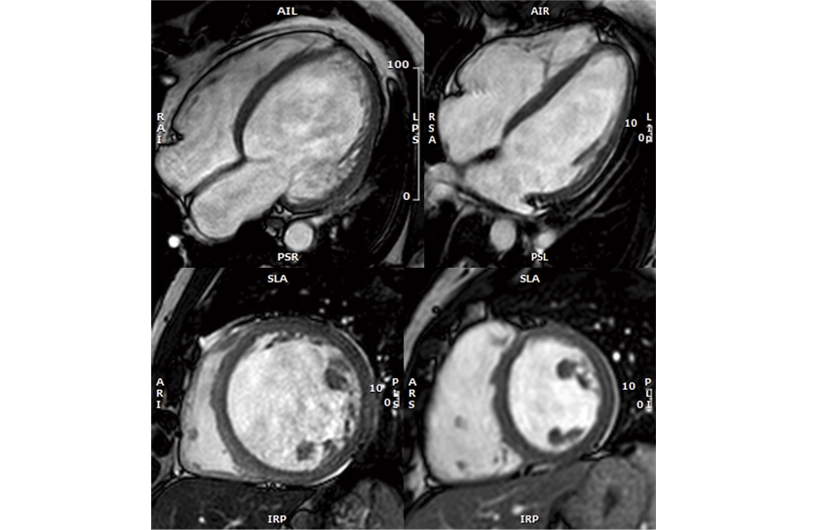
La miocardiopatía dilatada es una causa frecuente de insuficiencia cardíaca en jóvenes y la principal razón de trasplante cardíaco globalmente, caracterizada por el agrandamiento del corazón y su incapacidad para bombear sangre adecuadamente, además de arritmias y muerte súbita. Aproximadamente el 30-40% de los casos tienen un origen genético, permitiendo la posibilidad de estudiar a los familiares para identificar la presencia de la alteración genética y, por tanto, el riesgo potencial de desarrollar la enfermedad.
Un estudio liderado por el Dr. Pablo García-Pavía del CNIC y publicado en Journal of the Aerican College of Cardiology ha investigado las probabilidades de que los portadores genéticos desarrollen miocardiopatía dilatada. El estudio, que incluyó a 25 hospitales españoles y más de 779 personas de 300 familias, encontró que el 11% de los portadores desarrollaron la enfermedad tras un seguimiento promedio de 37 meses. Además, el riesgo variaba según el tipo de alteración genética y otras características como la edad, alteraciones en el electrocardiograma y el tamaño del corazón.
El trabajo también identificó que los pacientes con alteraciones en genes sarcoméricos o con fibrosis en el corazón, detectada por resonancia magnética, tenían un mayor riesgo de desarrollar la enfermedad. Estos hallazgos permitirán personalizar el seguimiento de los portadores genéticos, adaptando la frecuencia de las revisiones según los parámetros de riesgo identificados, mejorando así la detección temprana y el manejo de la miocardiopatía dilatada.
Este estudio ha sido financiado por la Sociedad Española de Cardiología (Beca en Enfermedades Cardíacas Hereditarias 2022) y el Instituto de Salud Carlos III a través de los proyectos “PI18/0004, PI20/0320” (cofinanciado por el Fondo Europeo de Desarrollo Regional/Fondo Social Europeo “Una manera de hacer Europa”/”Invertir en su futuro”).
PNAS
Identifican las células clave para prevenir la aterosclerosis en el síndrome de progeria

El síndrome de progeria de Hutchinson-Gilford (HGPS) es una enfermedad genética extremadamente rara que causa envejecimiento acelerado, aterosclerosis severa y muerte prematura a una edad media de 15 años. A pesar de que los pacientes no presentan factores de riesgo cardiovascular típicos, la aterosclerosis prematura es la principal causa de muerte. HGPS resulta de una mutación en el gen LMNA que produce progerina, una versión dañina de la proteína lamina A.
Investigaciones recientes han mostrado que la edición génica puede corregir esta mutación, eliminando progerina y restaurando la lamina A, lo que mejora los síntomas y prolonga la vida en modelos animales. Un estudio publicado en PNAS investigó la efectividad de eliminar progerina en células endoteliales y en células de músculo liso vascular, dos tipos celulares claves en la aterosclerosis. Los resultados indicaron que la eliminación de progerina en células endoteliales no proporcionó beneficios, mientras que su eliminación en células de músculo liso vascular redujo significativamente la aterosclerosis y otras complicaciones.
Estos hallazgos sugieren que enfocar la terapia génica en las células de músculo liso vascular podría ser suficiente para tratar la aterosclerosis asociada a HGPS, posiblemente utilizando dosis más bajas de reactivos de edición génica.
Este estudio ha sido posible gracias al apoyo del Ministerio de Ciencia, Innovación y Universidades (MICIU)/Agencia Estatal de Investigación (AEI)/10.13039/501100011033 y ERDF/EU (grants PID2022-141211OB-I00 y PID2022-137111OA-I00); la Comunidad Autónoma de Madrid (grants 2017-T1/BMD-5247 y 2021-5A/BMD-20944) cofinanciado con Fondos Estructurales de Inversión Europeos; RYC2021-033805-I (MICIU/AEI/10.13039/501100011033, European Union NextGenerationEU/PRTR); Ministerio de Educación, Cultura y Deporte; Fundación “la Caixa”; y el Wellcome Trust. El CNIC recibe apoyo del Instituto de Salud Carlos III (ISCIII), del MICIU, de la Fundación Pro-CNIC, y es un Centro de Excelencia Severo Ochoa (CEX2020-001041-S financiado por MICIU/AEI/10.13039/501100011033).
Development Cell
Un estudio del CNIC revela el papel clave de las proteínas de la mitocondria en la regeneración cardíaca

Un estudio del CNIC y la Universidad de Berna ha revelado nuevos aspectos sobre el papel de las mitocondrias en la regeneración cardíaca. Publicado en Development Cell, el estudio, dirigido por el Dr. José Antonio Enríquez y la Dra. Nadia Mercader, identifica a la familia de proteínas cox7a como crucial en el ensamblaje del complejo IV (CIV) de la cadena respiratoria mitocondrial, esencial para la producción de energía celular. La investigación se centró en tres miembros de esta familia: Cox7a1, Cox7a2, y Cox7a2l (SCAF1). Los científicos descubrieron que Cox7a1 es fundamental para la formación de dímeros del CIV. Usando un modelo de pez cebra, observaron que la ausencia de Cox7a1 afectaba negativamente el peso y la capacidad de natación, pero también mejoraba la respuesta regenerativa del corazón tras una lesión cardíaca. El estudio mostró que la pérdida de Cox7a1 en el corazón mejora su capacidad de recuperación después de un daño, sugiriendo que estas proteínas influyen en la regeneración cardíaca. Además, se identificaron cambios metabólicos significativos en los músculos de los peces sin Cox7a1, lo que podría tener implicaciones para el tratamiento de enfermedades cardíacas y metabólicas. Este hallazgo marca un avance importante en la comprensión de la regeneración cardíaca y sugiere que las proteínas de ensamblaje mitocondrial pueden jugar un papel clave en el control del metabolismo celular. Este trabajo ha recibido ayudas del programa de investigación e innovación Horizon 2020 de la Unión Europea, bajo el acuerdo de subvención No 874764 y 819717, así como del Programa de Fronteras de Ciencias Humanas HSFP RGP0016/2018 y la subvención de la Fundación Suiza de Ciencias Nacionales 320030E-164245.
Nucleic Acids Research
Un equipo del CNIC crea una innovadora herramienta para estudiar la función de los genes de forma más segura y eficaz

Un equipo del CNIC, dirigido por Rui Benedito, ha desarrollado una nueva herramienta genética llamada iSuRe-HadCre, que mejora la precisión y fiabilidad en la alteración genética de tejidos o células individuales. Publicada en Nucleic Acids Research, esta tecnología supera las limitaciones del sistema Cre-Lox, tradicionalmente utilizado para el análisis de función génica.
El sistema Cre-Lox ha sido fundamental en la investigación biomédica debido a su capacidad para manipular la expresión génica de manera espacial y temporal. Sin embargo, presenta problemas como variabilidad en la eficiencia de la recombinación y la necesidad de controles costosos para asegurar la correcta ejecución de los experimentos.
La nueva herramienta iSuRe-HadCre emplea una cascada genética de doble recombinasa inducible que asegura que las células con un marcador fluorescente hayan tenido alta actividad de Cre, pero ya no la mantengan. Esto permite una alteración genética precisa y elimina la toxicidad y las recombinaciones esporádicas asociadas con la expresión constante de Cre. Además, iSuRe-HadCre es más sensible a la inducción por CreERT2 y tamoxifeno.
Rui Benedito destaca que iSuRe-HadCre es una herramienta clave para estudios avanzados en genética, incluyendo microscopía de alta resolución, análisis funcionales y estudios de epistasis genética, permitiendo modificaciones genéticas simultáneas con alta eficiencia.
Este estudio ha sido financiado por el Ministerio de Ciencia e Innovación, Fundación “la Caixa”, Consejo Europeo de Investigación, Fundación Leducq, Fundación Knut y Alice Wallenberg y la Fundación Göran Gustafsson.













