EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
eLife
Desvelan las funciones opuestas de las proteínas p38 en la hipertrofia cardiaca
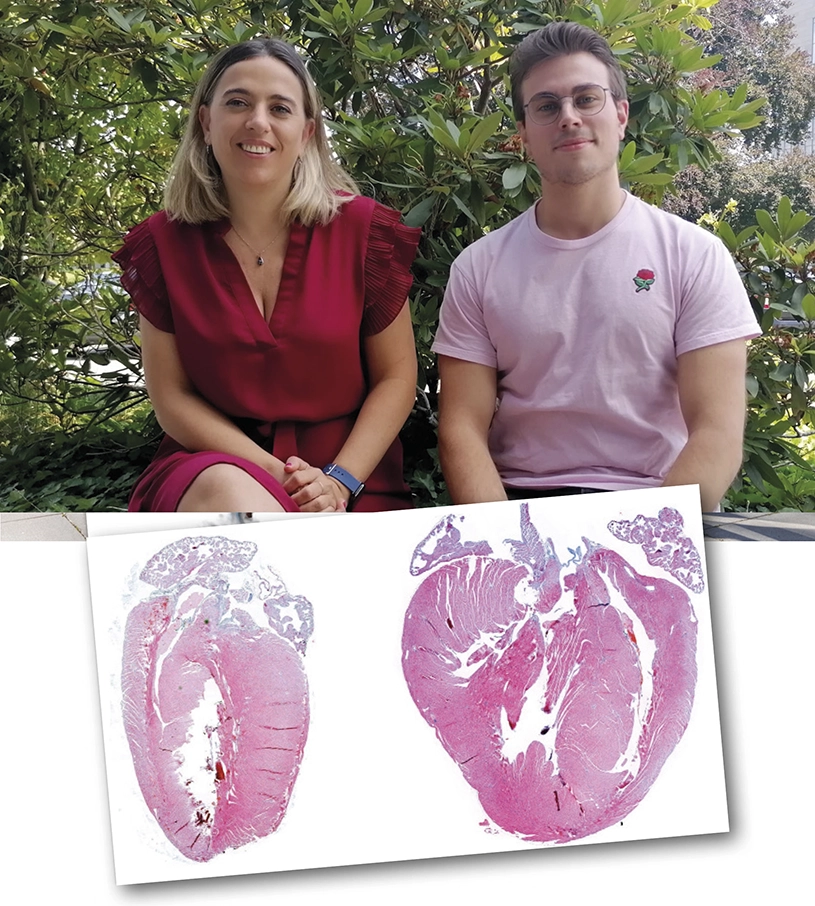
Una investigación del CNIC identificó un papel clave para la vía MKK3/6-p38γ/δ en el desarrollo de hipertrofia cardiaca. La información publicada en la revista eLife sugiere que la inhibición de p38γ/δ podría ser una estrategia terapéutica útil para tratar patologías como la miocardiopatía hipertrófica, pero permanece inexplorada debido a la falta de inhibidores específicos para estas proteínas. Por otro lado, tiene implicaciones importantes para el uso clínico a largo plazo de los inhibidores existentes de p38α, ya que pueden ser perjudiciales para el corazón.
Dentro del cardiomiocito, existen numerosas moléculas que se activan para promover la hipertrofia cardiaca. “Una de ellas es la vía p38, que es activada por estímulos inductores de estrés”, explica Rafael Romero, autor principal de este estudio. Las proteínas p38 controlan un amplio espectro de procesos y su desregulación se ha relacionado con numerosas enfermedades, convirtiéndolas en una prometedora diana farmacológica para uso terapéutico. Sin embargo, solo se han conseguido inhibidores específicos de la p38α y los resultados de los ensayos clínicos con humanos hasta ahora han sido decepcionantes. Como alternativa a la inhibición de la p38α, otras proteínas de la ruta como las p38γ y p38δ o la MKK6 constituyen dianas farmacológicas potenciales interesantes.
El grupo del CNIC coordinado por la Dra. Guadalupe Sabio decidió evaluar si la inhibición de MKK6 podría ser segura y si había efectos negativos a largo plazo. Utilizando ratones mutantes carentes de MKK6, han mostrado que la deficiencia de esta proteína reducía la esperanza de vida de estos ratones: cuando eran jóvenes desarrollaban hipertrofia cardiaca, que con la edad progresaba a disfunción cardiaca. Usando diferentes modelos de ratón, demostraron que, cuando MKK6 está ausente, la activación de p38α, uno de los miembros de la familia p38, se reduce significativamente.
Sin embargo, la inactivación de p38α promueve una activación inesperada de otra rama de la vía, las proteínas MKK3, p38γ y p38δ. Esto resultó en la activación de otra de las rutas clave en el desarrollo de la hipertrofia cardiaca, la ruta de mTOR.
Este trabajo ha sido financiado por: MINECO-FEDER; American Heart Association; EFSD/Lilly European Diabetes Research; Fundación AECC y Comunidad de Madrid IMMUNOTHERCAN-CM; Instituto Nacional de Corazón, Pulmón y Sangre; Fundación “la Caixa”; Fundació La Marató de TV3: Programa FP7 Marie Curie; Premio EFSD Rising Star y JDC-2018-Incorporación (MIN/JDC1802).
The New England Journal of Medicine
La polipíldora reduce la mortalidad cardiovascular en un 33% en pacientes tratados tras un infarto

La polipíldora desarrollada por CNIC y Ferrer, que incluye tres medicamentos (aspirina, un inhibidor de la enzima convertidora de angiotensina (ECA) y una estatina), es eficaz en la prevención de eventos cardiovasculares tras un ataque al corazón, disminuyendo la mortalidad por causas cardiovasculares en un 33%. Así lo muestra el estudio SECURE, coordinado por el CNIC, cuyos resultados se publicaron en NEJM.
SECURE incluyó a 2.499 pacientes de siete países europeos (España, Italia, Alemania, República Checa, Francia, Polonia y Hungría) que habían sufrido un infarto de miocardio, a los que se asignó de forma aleatoria a recibir un tratamiento estándar o la polipíldora del CNIC.
El objetivo primario del estudio incluyó eventos cardiovasculares mayores: muerte por causas cardiovasculares, infarto de miocardio no mortal, ictus o revascularización urgente. El estudio encontró una disminución del riesgo acumulado de presentar estos cuatro eventos del 24% en pacientes que recibieron la polipíldora, frente a los que continuaron tomando el tratamiento por separado de forma habitual.
Especialmente relevantes son los efectos de la polipíldora sobre una de las variables más determinantes, la incidencia de muerte cardiovascular, que disminuyó en un 33%, pasando de 71 pacientes en el grupo de tratamiento habitual a 48 en el grupo de la polipíldora .
Además, los pacientes del grupo de la polipíldora presentaban niveles más altos de adherencia en comparación con los del grupo de atención habitual, confirmando así los hallazgos obtenidos en el estudio FOCUS, también financiado por la Unión Europea.
SECURE ha sido financiado por el programa de investigación e innovación Horizonte 2020 de la UE (identificador de ensayo NCT02596126).
Journal of the American College of Cardiology
El CNIC y el Hospital Puerta de Hierro diseñan una herramienta que determina si la miocardiopatía dilatada es de origen genético

Una investigación del CNIC y el Hospital Universitario Puerta de Hierro Majadahonda, en colaboración con 20 hospitales de España, Italia y Países Bajos, ha desarrollado una herramienta que permite predecir las posibilidades de que la causa de la miocardiopatía dilatada sea genética. La información, que se publicó en JACC, permitirá ajustar mejor el tratamiento de los pacientes con esta enfermedad y, además, identificar si otros familiares también han heredado la patología. La herramienta está disponible online: www.madriddcmscore.com.
La miocardiopatía dilatada es la causa más frecuente de insuficiencia cardiaca en jóvenes y la principal causa de trasplante en todo el mundo. Sin embargo, en muchos lugares del mundo no se realiza de forma habitual un estudio genético a los pacientes con miocardiopatía dilatada, debido a que es una prueba que acarrea costes considerables y que solo es positiva en uno de cada tres pacientes.
El estudio, liderado por el Dr. Pablo García-Pavía, cardiólogo del Hospital Puerta de Hierro e investigador del CNIC y del CIBER de Enfermedades Cardiovasculares (CIBERCV), analizó las características clínicas, el electrocardiograma y las ecografías de un grupo de 1.015 pacientes con miocardiopatía dilatada estudiados genéticamente en 20 hospitales españoles. Los resultados mostraron que había cinco parámetros que eran más frecuentes entre los pacientes en los que la enfermedad se debía a una alteración genética.
La combinación de estos cinco parámetros en un programa informático, denominado Madrid Genotype Score, permitió clasificar a los pacientes según las posibilidades de que la enfermedad estuviese causada o no por una alteración genética. Los investigadores verificaron la capacidad predictiva del programa con un grupo independiente de 1.097 pacientes con miocardiopatía dilatada procedentes de Italia y Países Bajos.
El programa informático desarrollado se ha puesto a disposición de todos los profesionales del sector médico del mundo de forma gratuita gracias a la citada página web.
Cellular and Molecular Sciences
Describen un nuevo mecanismo que relaciona la inflamación y el remodelado cardiovascular patológico

La respuesta inmuno-inflamatoria contribuye al remodelado patológico de las arterias en distintas enfermedades cardiovasculares. Una investigación, que publicó CMLS, ha arrojado nueva luz sobre uno de los mecanismos que vinculan la respuesta inmuno-inflamatoria con la enfermedad vascular, al describir el papel clave que desempeña el antígeno de activación temprana de linfocitos CD69. El estudio, fruto de la colaboración de dos grupos del CIBERCV en la Universidad Autónoma de Madrid (UAM)/CNIC y en el IIBB-CSIC/IIB-Sant Pau, abre el camino a nuevas estrategias terapéuticas.
El antígeno de activación temprana de linfocitos CD69 es un receptor que se induce tras la estimulación de los leucocitos. Investigaciones previas de estos equipos identificaron el papel de CD69 como un receptor de lipoproteínas de baja densidad oxidadas (oxLDL) en linfocitos T humanos (un tipo de célula inmunitaria), una unión que da lugar a una respuesta antiinflamatoria que protege frente a la aterosclerosis. A partir de este trabajo, en este nuevo estudio se centraron en buscar su posible papel en los mecanismos que controlan la respuesta inflamatoria-inmune y su vinculación con la remodelación tisular en las enfermedades cardiovasculares.
Mediante análisis de expresión de ARN a gran escala (RNAseq), se observó que la unión de CD69 a las LDL oxidadas induce la expresión de PD-1 (una proteína que se encuentra en los linfocitos T y que contribuye al control de las respuestas inmunitarias) y que este mecanismo participa en la regulación de la respuesta inflamatoria.
“Este mecanismo de inducción de PD-1 mediado por CD69 contribuiría a modular la inflamación y el remodelado cardiovascular que se produce como consecuencia de la misma”, explican Francisco Sánchez Madrid y José Martínez González, jefes de grupo del CIBERCV en la UAM y el IIBB-CSIC, respectivamente, y coordinadores de este nuevo trabajo.
British Journal of Pharmacology
Demuestran el papel neuroprotector de metoprolol tras un ictus

Con un fármaco de apenas 2 euros se podría proteger un cerebro tras haber sufrido un ictus y reducir muchas de sus secuelas, beneficiando así a millones de pacientes. Se trata del metoprolol, medicamento de la familia de los betabloqueantes, empleado en la clínica desde hace más de 40 años en cardiología, que ahora ha demostrado tener un efecto neuroprotector único.
Lo confirma un trabajo llevado a cabo por investigadores del CNIC, del Hospital Universitario Fundación Jiménez Díaz y del CIBERCV, dirigido por el Dr. Borja Ibáñez y publicado en la revista BJP.
El grupo del Dr. Ibáñez, director del departamento de Investigación Clínica del CNIC, ha demostrado en un modelo de rata que el tratamiento con metoprolol es capaz de proteger al cerebro durante un ictus y reducir considerablemente sus consecuencias posteriores. Las ratas que recibieron metoprolol intravenoso durante el curso del ictus, mostraron una menor inflamación cerebral y muerte neuronal, que a largo plazo se tradujo en una mejoría en las capacidades neuromotoras del animal.
El estudio ha recibido financiación del Instituto de Salud Carlos III; el Fondo Europeo de Desarrollo Regional (FEDER) “Una forma de hacer Europa”; Comunidad de Madrid cofinanciado con los Fondos Estructurales y de Inversión Europeos y por la Agencia Estatal de Investigación, y el Consejo Europeo de Investigación (ERC) a través del Programa de Investigación e Innovación Horizonte 2020.
Nature Metabolism
Desvelan cómo el organismo optimiza la capacidad respiratoria al hacer ejercicio

Un equipo de investigadores del CNIC y el CBMSO, en colaboración con el laboratorio del Prof. Johan Auwerx, de la Universidad de Lausana (Suiza), confirmó en humanos el mecanismo molecular por el cual la mitocondria adapta uno de sus elementos, la cadena de transporte de electrones (CTE), cuya función es la producción de energía, para optimizar el metabolismo, las funciones cardiorrespiratorias, y la capacidad de realizar ejercicio físico.
La CTE está formada por cuatro grandes complejos multiproteicos, —CI, CII, CIII y CIV—, que tienen la capacidad de reorganizarse estructuralmente de diferentes maneras para realizar distintas funciones y adaptarse a las condiciones del entorno, explica el Dr. José Antonio Enríquez, jefe del grupo Genética Funcional del Sistema de Fosforilación Oxidativa del CNIC y autor de la investigación.
La proteína SCAF1 es un factor clave en la organización de la CTE. El trabajo muestra que la expresión de SCAF1 está regulada en humanos por variantes genéticas poblacionales. Los datos obtenidos en humanos, explica la Dra. Sara Cogliati, “demuestran que existe una variable genética de SCAF1 que determina una mayor expresión en los músculos y el corazón”.
El estudio muestra también que dicha variable genética se distribuye de forma diferente entre las poblaciones de distintos continentes, “lo que sugiere un posible papel adaptativo de la organización de la CTE frente a diferentes situaciones ambientales” indica el Dr. Enríquez. Los investigadores concluyen que estos resultados definen por primera vez en humanos un papel fundamental de la CTE como elemento clave en la adaptación del metabolismo a distintas demandas energéticas.
Este estudio ha sido financiado parcialmente por becas de la École Polytechnique Fédérale de Lausana (EPFL), el Consejo Europeo de Investigación, el Swiss National Science Foundation, la Fundación Marcel Levaillant, la Fondation Suisse de Recherche sur les Maladies Musculaires (FSRMM) y la subvención GRL de la Fundación Nacional de Investigación de Corea, del Centro de Investigación HUNT; Ministerio de Ciencia, Innovación y Universidades, Agencia Estatal de Investigación (AEI) y Fondo Europeo de Desarrollo Regional (FEDER), CIBERFES-ISCiii, y la agencia HFSP.
Nature Cardiovascular Research
Desvelan la causa de las arritmias y la muerte súbita en el síndrome de Andersen Tawil tipo 1

Dos equipos de investigadores del CNIC han descubierto la causa de las arritmias y la muerte súbita en la enfermedad llamada síndrome de Andersen-Tawil tipo 1, una patología que está producida por mutaciones en proteínas que forman canales de potasio reguladores de la actividad eléctrica y del ciclo de calcio intracelular en el corazón y el músculo esquelético y que se caracteriza por frecuentes arritmias ventriculares, asociadas a alteraciones del desarrollo de grado muy variable.
Dirigidos por los Drs. José Jalife y Juan Antonio Bernal, los investigadores han descubierto una función fundamental previamente desconocida de los canales Kir2.1, que controlan las propiedades eléctricas esenciales de células excitables como el músculo cardiaco, el músculo esquelético y las neuronas.
En el estudio publicado en NCR, los equipos del CNIC han demostrado que estos dos distintos microdominios de proteína Kir2.1 están presentes en diferentes especies y en diferentes células musculares, lo que indica que son funciones relevantes conservadas y generalizadas en las células.
Además, señala el Dr. Bernal, los datos “también reportan la generación y la caracterización detallada de un nuevo modelo de ratón de la enfermedad hereditaria llamada síndrome de Andersen Tawil tipo 1 (ATS1)”.
El proyecto ha recibido financiación de la Fundación “la Caixa”; Proyecto SQTS de la convocatoria pública Proyectos de investigación en salud 2020, financiado por el Instituto de Salud Carlos III (ISCIII) y cofinanciado por la Unión Europea (FEDER/FSE); Fundació La Marató de TV3, y el programa Horizonte 2020 de la Unión Europea.
Journal of Clinical Investigation
Descubren un factor clave que protege el corazón tras un infarto

Un estudio realizado en el CNIC desveló un factor clave que protege al corazón tras un infarto. La investigación, liderada por la Dra. Pilar Martín, jefa del Grupo de Moléculas Reguladoras de los Procesos Inflamatorios del CNIC, y publicada en la revista JCI, describe que la expresión del receptor CD69 en los linfocitos T reguladores confiere protección después de sufrir un infarto de miocardio, ya que actúa como punto de control de la inflamación exacerbada responsable del daño cardiaco a medio plazo.
Además, este trabajo, en el que han participado investigadores del CIBERCV del grupo del Dr. Francisco Sánchez-Madrid en el CNIC y el Hospital Universitario de La Princesa, y del grupo del Dr. José Martínez-González en el IIBB-CSIC y el IIB-Sant Pau, desvela que niveles de expresión de este receptor CD69 en sangre periférica podría predecir el desarrollo de fallo cardiaco, es decir, de secuelas graves en la funcionalidad del corazón.
Los investigadores han descubierto que se produce un aumento de la expresión de este receptor CD69 en linfocitos T reguladores en las primeras horas tras el evento isquémico. Gracias a los experimentos con modelos de ratón, se ha desvelado que la ausencia de CD69 conlleva un aumento de la inflamación, de la disfunción cardiaca y de la tasa de muerte tras el infarto.
La investigación también ha visto que un dato muy relevante, la terapia con células T reguladoras que expresan CD69 tras un infarto en ratones deficientes en CD69, es suficiente para suplir la deficiencia de esta molécula y así disminuir la inflamación cardiaca y mejorar la supervivencia.
El seguimiento de pacientes con infarto de dos cohortes independientes reveló otro resultado muy prometedor para la clínica. Los niveles de expresión de CD69 en sangre periférica sirven para predecir el desarrollo de fallo cardiaco, es decir, de secuelas graves en la funcionalidad del corazón.
Este estudio ha contado con el apoyo del Ministerio de Ciencia e Innovación (MCIN), a través del Instituto de Salud Carlos III (ISCIII)-Fondo de Investigación Sanitaria; Becas Comunidad de Madrid; Fundació La Marató de TV3; CIBERFES, Human Frontier Science Program; Leducq Transatlantic Networks; Marie Skłodowska-Beca, y apoyo de Formación de Profesorado Universitario programa del Ministerio de Educación, Cultura y Deportes.
Cell Stem Cell
Identifican un mecanismo que mantiene la función mitocondrial en las células madre musculares y que puede estimularse en la vejez
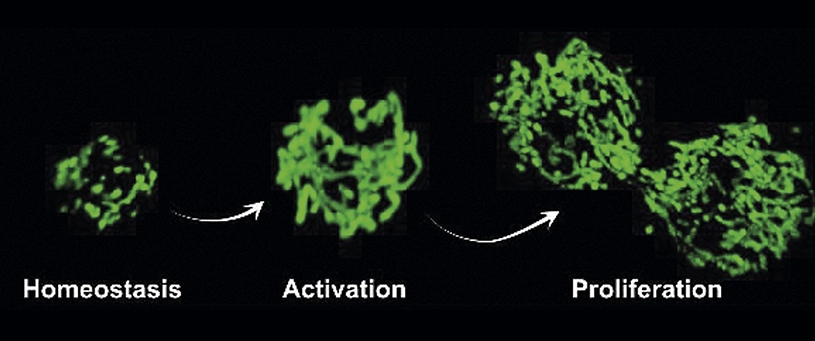
Investigadores del CNIC, la Universidad Pompeu Fabra, ICREA y CIBERNED han identificado un mecanismo fisiológico que sustenta la capacidad regenerativa de las células madre musculares, y que falla durante el envejecimiento. Sin embargo, tal y cómo se demuestra en el estudio que se publica en la revista CSC, dicho mal funcionamiento se puede superar genética y farmacológicamente, restaurando así las funciones regenerativas de las células madre antiguas.
La regeneración del músculo esquelético depende de una población de células madre musculares (células satélite) en un estado activo o inactivo, una situación que puede desencadenarse por daño o estrés para formar nuevas fibras musculares y expandirse en nuevas células madre.
Se sabe que las funciones regenerativas de estas células madre disminuyen con el envejecimiento. Ahora, la Dra. Pura Muñoz-Cánoves, investigadora del CNIC y profesora de la UPF de Barcelona, y CIBERNED, y el Dr. José Antonio Enríquez, investigador del CNIC y CIBERFES, y sus colegas, han encontrado, en experimentos realizados con ratones, que la dinámica mitocondrial es necesaria para la regeneración de tejidos.
La fisión mitocondrial facilita la función de las células madre musculares a través de OXPHOS y la regulación de la autofagia mitocondrial (mitofagia). Los investigadores han demostrado que la pérdida genética del regulador de fisión mitocondrial DRP1 en las células madre musculares (o durante el envejecimiento) entorpece su capacidad de proliferación y regeneración, mientras que su restablecimiento rescata estos defectos. Según los resultados, la normalización de la dinámica mitocondrial (o el aumento de OXPHOS y la mitofagia) en las células madre musculares envejecidas restaura la regeneración del tejido.
Este estudio ha sido financiado parcialmente por subvenciones del Consejo Europeo de Investigación (ERC), el Ministerio de Ciencia e Innovación de España, la Fundación “la Caixa”, Human Frontier Science Program y la Fundación Leduq (LeduqRedox).
Circulation
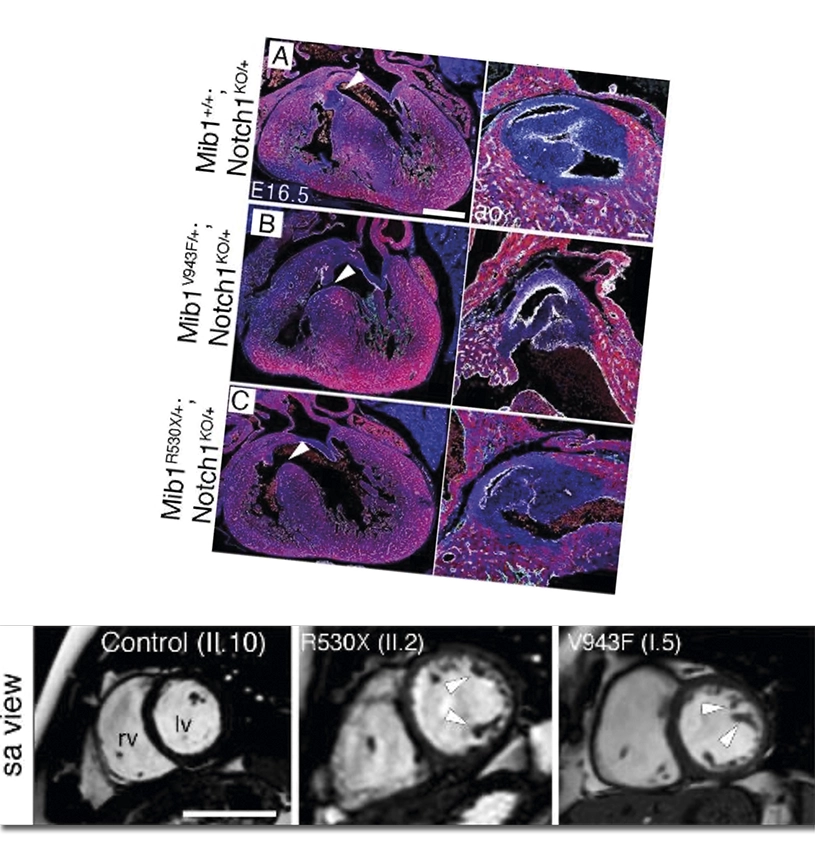
Distintos genes modificadores determinan el efecto de dos mutaciones causantes de miocardiopatía

La miocardiopatía no compactada es una patología provocada por defectos durante el desarrollo prenatal que puede tener repercusiones muy diversas en la salud de los pacientes que la sufren, llegando incluso a provocar la muerte súbita. El grupo de Señalización Intercelular durante el Desarrollo del CNIC ya descubrió que esta enfermedad podía ser causada por dos mutaciones distintas en el gen Mindbomb1 (Mib1).
Ahora, este mismo grupo, en colaboración con distintos grupos CIBERCV y CIBER de Bioingeniería, ha desvelado que el hecho de que haya una mutación en dicho gen no siempre conduce al desarrollo de la enfermedad por sí sola, sino que es dependiente del contexto genético y las otras mutaciones que “modifiquen” su efecto.
Los investigadores describen en un estudio publicado en Circulation cómo diversas mutaciones acompañantes de una mutación supuestamente “causal” de esta enfermedad cardiaca congénita pueden contribuir a su severidad y a la manifestación de distintas anomalías, según se combinen entre sí en un paciente. El equipo liderado por el Dr. José Luis de la Pompa introdujo dichas mutaciones en el genoma del ratón utilizando la técnica ‘CRISPR-Cas9’.
Usando estos modelos animales, descubrieron que los ratones mutantes padecían miocardiopatía no compactada del ventrículo izquierdo, pero únicamente si eran portadores de dos alelos mutantes para Mib1. Es decir, explica el Dr. De la Pompa, “se trataba de una situación distinta de la observada en pacientes, en los que la enfermedad se manifiesta en presencia de una única versión mutante de MIB1. Además, los ratones mostraban defectos en las válvulas cardiacas, o ambas anomalías a la vez”.
Para tratar de entender qué ocurría, y gracias a la ayuda de los pacientes y sus familias y de colaboradores de diversos centros, especialmente del grupo del Dr. Juan Ramón Gimeno, del Hospital Universitario Virgen de la Arrixaca (Murcia), consiguieron secuenciar muestras de más miembros de la familia sanos y que padecen la enfermedad.
Estos descubrimientos permiten avanzar en el conocimiento de la LVNC en particular, pero también refuerzan la idea de que la enfermedad congénita cardiaca no siempre es monogénica, sino que varias mutaciones pueden intervenir en su aparición, es decir, tener una herencia oligogénica.
Este estudio ha contado con ayudas del MCIN/AEI; CIBER CV; la Fundación BBVA; la Comisión Europea (subvención H2020-HEALTH); el Consejo de Investigación Médica; la Fundación Británica del Corazón, y la Fundació La Marató de TV3.
Basic Research in Cardiology
Identifican una nueva diana terapéutica capaz de prevenir la insuficiencia cardiaca asociada a estenosis aórtica
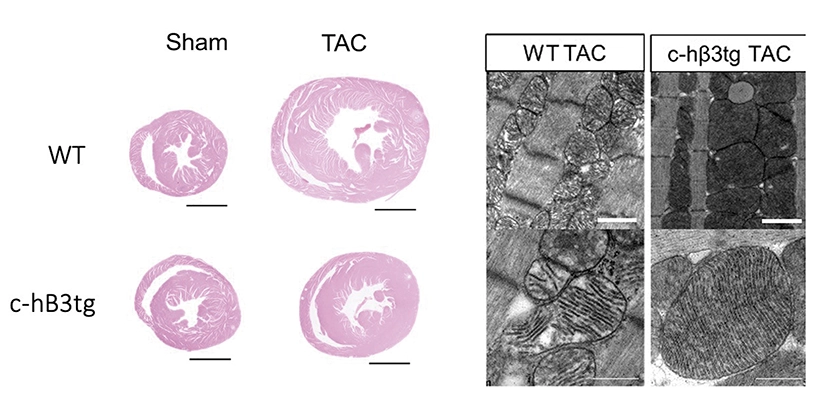
El equipo liderado por el Dr. Borja Ibáñez, director del Departamento de Investigación Clínica del CNIC, ha visto que la sobreexpresión de una molécula, un receptor para la adrenalina poco conocido perteneciente al sistema beta adrenérgico (beta3adrenergico) en las células musculares cardiacas (cardiomiocitos) era capaz de prevenir e incluso revertir la insuficiencia cardiaca en un modelo de estenosis aórtica, una situación para la que actualmente hay escasez de terapias.
En el trabajo que se publicó en la revista BRC, los investigadores han empleado un abordaje muy novedoso basado en el incremento de la expresión de este receptor en el corazón mediante terapia génica para potenciar aún más su efecto beneficioso.
La estenosis aórtica es un estrechamiento progresivo de la válvula aórtica, una “compuerta” a través de la cual pasa la sangre desde el corazón al resto del cuerpo. Actualmente, el tratamiento consiste en recambiar la válvula por una prótesis, y esto se lleva a cabo por abordajes cada vez menos invasivos.
Sin embargo, pese a sustituir la válvula y restablecer el correcto funcionamiento de apertura y cierre de esta “compuerta”, en muchas ocasiones el músculo cardiaco, sometido a estrés durante mucho tiempo, no se recupera. Desafortunadamente, actualmente hay escasez de terapias que mejoren el músculo cardiaco y, por tanto, alivien de insuficiencia cardiaca en estos casos de estenosis aórtica de larga duración.
En el estudio se explotan las propiedades beneficiosas de la estimulación del receptor beta3adrenergico, un receptor presente en abundancia en tejido graso y vejiga urinaria, pero poco en el corazón.
En colaboración con el grupo del Dr. José Luis de la Pompa, se generó un ratón transgénico que sobreexpresaba dicho receptor en los cardiomiocitos. Cuando se sometió al ratón a una estenosis aórtica supravalvular, desarrolló menos hipertrofia y menos fibrosis cardiaca que los ratones que no sobreexpresaban el receptor. Además, no desarrollaba insuficiencia cardiaca y sus corazones eran metabólicamente más eficientes, ya que consumían menos glucosa.
Debido a que este modelo de animales transgénicos no tiene aplicación directa en los pacientes, los investigadores utilizaron una terapia génica que consiste en inyectar virus inocuos en el organismo capaces de llegar al corazón y producir receptores de manera eficaz y segura.
En colaboración con la Unidad de Vectores Virales del CNIC, diseñaron un virus inocuo capaz de entrar de manera específica en los cardiomiocitos y generar una sobreexpresión del receptor beta3adrenergico en los corazones de ratones no transgénicos adultos. Y vieron que, en los animales sometidos a una estenosis aórtica, los resultados eran tan beneficiosos como los observados en los animales transgénicos que nacían con el receptor ya sobreexpresado.
Por último, inocularon el virus en animales no transgénicos con estenosis aórtica de larga duración que ya presentaban signos de insuficiencia cardiaca y comprobaron que la sobreexpresión del receptor gracias a la terapia génica permitía una recuperación de la función cardiaca, una reducción de la hipertrofia, así como una restauración del tamaño de las mitocondrias y de los niveles de proteínas reguladoras de la fusión mitocondrial en el corazón y un aumento de la supervivencia de los animales.
El estudio ha recibido ayudas del Ministerio de Ciencia e Innovación de España (MICINN); Comisión Europea; ERA-CVD Joint Translational Call 2016; Fondo Regional Europeo de Fomento (FEDER); Fundación BBVA; CIBERCV, y TERCEL.
European Journal of Heart Failure
Un fármaco se muestra prometedor en pacientes con hipertensión pulmonar secundaria a cardiopatía
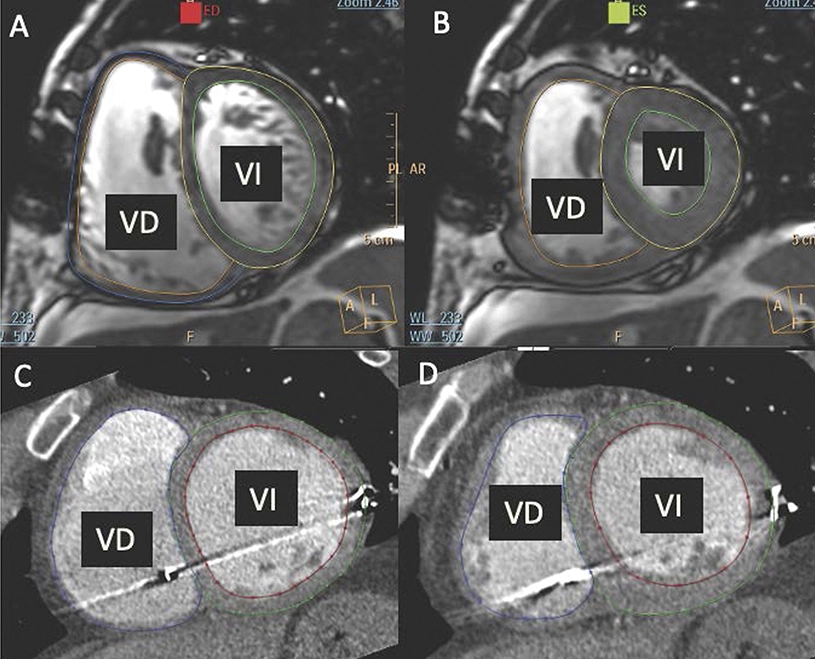
Los pacientes con hipertensión pulmonar secundaria a cardiopatía, una patología altamente prevalente y asociada a un mal pronóstico, no disponen de ninguna terapia específica para el tratamiento de su enfermedad. Ahora, un estudio del CNIC y el Hospital Clínic de Barcelona/IDIBAPS ha demostrado que mirabegron, un medicamento que actúa a nivel de los receptores adrenérgicos beta-3, podría tener un efecto beneficioso a nivel de la función del ventrículo derecho.
El estudio SPHERE-HF ha evaluado por primera vez el potencial beneficio del mirabegron en los pacientes con hipertensión pulmonar secundaria a cardiopatía. Y aunque los resultados que se publican en EJHF han resultado neutros para el objetivo principal para el cual fue diseñado, resistencia vascular pulmonar, arrojan datos favorables en relación a la función del ventrículo derecho.
SPHERE-HF incluyó 80 pacientes de cuatro hospitales de tercer nivel —Sant Pau de Barcelona, Puerta de Hierro de Madrid, 12 de Octubre de Madrid y Clínic de Barcelona— que padecían una cardiopatía e hipertensión pulmonar secundaria, a los que se asignó de forma aleatoria a recibir tratamiento con mirabegron o placebo durante cuatro meses.
Todos los pacientes fueron evaluados mediante un cateterismo cardiaco derecho, para medir las presiones en el pulmón, y una resonancia magnética o una tomografía cardiaca, para evaluar la función del ventrículo derecho. La evaluación de todas las imágenes cardiacas se realizó de forma ciega y centralizada en el CNIC.
Estos resultados sugieren que los agonistas beta-3 podrían ser de utilidad en el manejo de la disfunción del ventrículo derecho, para el cual no disponemos de terapias que podamos usar de forma crónica.
Además, el estudio ha sido financiado por la Comisión Europea (ERC-Consolidator Grant Agreement No. 819775), el Ministerio de Ciencia e Innovación de España y la Comunidad de Madrid.
eLife
Identifican un proceso esencial en la respuesta mecánica celular que implica “nanopliegues” y “pegamento” en su superficie

Una investigación realizada en el CNIC ha identificado que un componente de las células, las caveolas, desempeña un papel esencial en la mecánica celular y cómo su disfunción puede estar implicada en diversos procesos como la agregación plaquetaria, las enfermedades cardiovasculares, la fibrosis o la formación de tumores. El artículo que se publica en eLife, liderado por los investigadores del CNIC Fidel-Nicolás Lolo y Miguel Ángel del Pozo, muestra que las caveolas, al limitar los cambios agudos de tensión de membrana, acoplan el estrés mecánico a la actividad de las integrinas, modulando, por tanto, la respuesta mecánica celular.
Los autores demuestran que las células que carecen del sistema de amortiguación de las caveolas ofrecen una respuesta mecánica disfuncional, como resultado de un aumento aberrante de los niveles de integrinas (los principales receptores de la matriz extracelular, una especie de “pegamento” entre la célula y su microambiente) activas en la membrana celular.
Las células descifran su microambiente mediante pequeños tirones y presiones que ejercen a través de un grupo de proteínas llamadas integrinas, que son receptores de la matriz extracelular localizados en la superficie celular. Las integrinas pueden oscilar entre dos estados de actividad: apagado y encendido, siendo este último el determinante en el escaneado microambiental.
La cantidad relativa de integrinas activas en la superficie celular, señala el Dr. Lolo, está controlada por dos mecanismos principales: la regulación de la tensión de la membrana plasmática y la dinámica del reciclado. Por su parte, las caveolas, pequeñas invaginaciones de la membrana plasmática, presentes en muchos tipos celulares diferentes, pueden regular la tensión de la membrana plasmática mediante cambios en su geometría.
Una respuesta mecánica celular apropiada es crítica para la homeostasis tisular —la habilidad para hacer frente a los desafíos ambientales y mantener los parámetros fisiológicos dentro de unos rangos viables—. Así, la incapacidad para detectar estos cambios ambientales tiene implicaciones en muchos procesos patológicos como la fibrosis, tumorigénesis y las enfermedades cardiovasculares, pudiendo desempeñar un papel relevante en fenómenos como la agregación plaquetaria.
La investigación ha contado con las ayudas del Programa de Innovación Unión Europea Horizonte 2020 Investigación a través de la acción estratégica ITN Marie Skłodowska-Curie, del Ministerio de Ciencia e Innovación de España (incluido el Programa Severo Ochoa), de la Fundación “la Caixa”; la Asociación Española Contra el Cáncer, la Fundació La Marató de TV3 y de la Comunidad de Madrid.
Blood
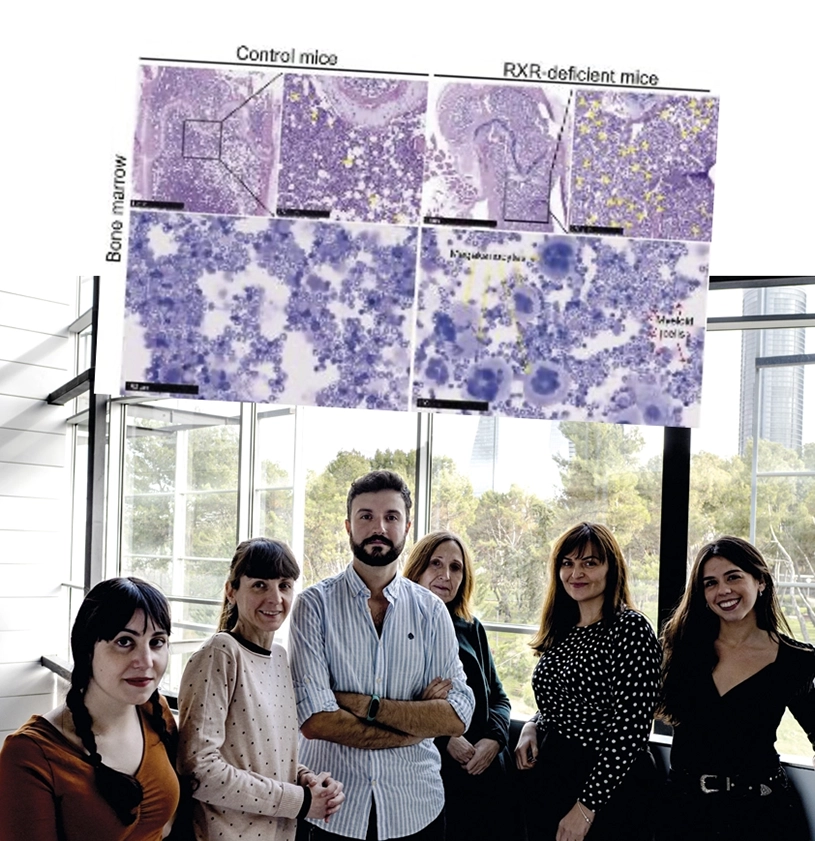
RXR, la proteína celular clave para mantener las células madre de la sangre jóvenes y entrenadas
Una proteína celular, denominada Receptor X de Retinoides (RXR), es clave para mantener nuestras células madre hematopoyéticas jóvenes y entrenadas y reducir así el riesgo de desarrollar síndromes mieloproliferativos asociados con el envejecimiento. Lo ha visto una investigación del CNIC que demuestra que el control que ejerce RXR sobre las células madre hematopoyéticas es fundamental en el mantenimiento de una producción equilibrada de los diferentes componentes celulares de la sangre a lo largo de la vida.
Los resultados publicados en Blood podrían tener implicaciones terapéuticas en patologías en las que una excesiva proliferación de células mieloides puede contribuir al desarrollo de la enfermedad, como algunas enfermedades hematológicas o cardiovasculares.
El equipo liderado por la Dra. Mercedes Ricote, del CNIC, y el Dr. José Cancelas, del Hospital Infantil de Cincinnati (Estados Unidos), ha demostrado que la eliminación de RXR en células madre hematopoyéticas de ratón provoca la expansión crónica de un subgrupo de células con sesgo megacariocítico (productores de plaquetas) y mieloide, condicionando un déficit del linaje linfoide y el desarrollo de un síndrome mieloproliferativo en ratones envejecidos. La investigación ha visto que el exceso de células mieloides inflamatorias de los ratones deficientes en RXR da lugar a la invasión de diversos tejidos, especialmente del pulmón, donde provocan un daño severo y la muerte prematura de estos ratones.
La colaboración de los equipos bioinformáticos de la Dra. Sánchez-Cabo (CNIC) y el Dr. Salomonis (Cincinnati) ha permitido utilizar técnicas de secuenciación masiva de última generación y realizar análisis exhaustivos sobre la estructura y expresión génica del ADN de las células madre hematopoyéticas. Los científicos destacan la posibilidad de modular la actividad de RXR en células madre hematopoyéticas mediante el uso de fármacos, alguno de ellos empleado en la actualidad para el tratamiento de linfomas cutáneos.
El estudio ha recibido ayudas a través de becas del Ministerio de Ciencia e Innovación de España (MICIN); Fundación La Marató de TV3; Comunidad de Madrid, y de los Institutos Nacionales de Salud de EE.UU.
Nature
Describen células senescentes que bloquean las funciones de sus células sanas vecinas e identifican formas de neutralizarlas y mejorar la regeneración de los tejidos
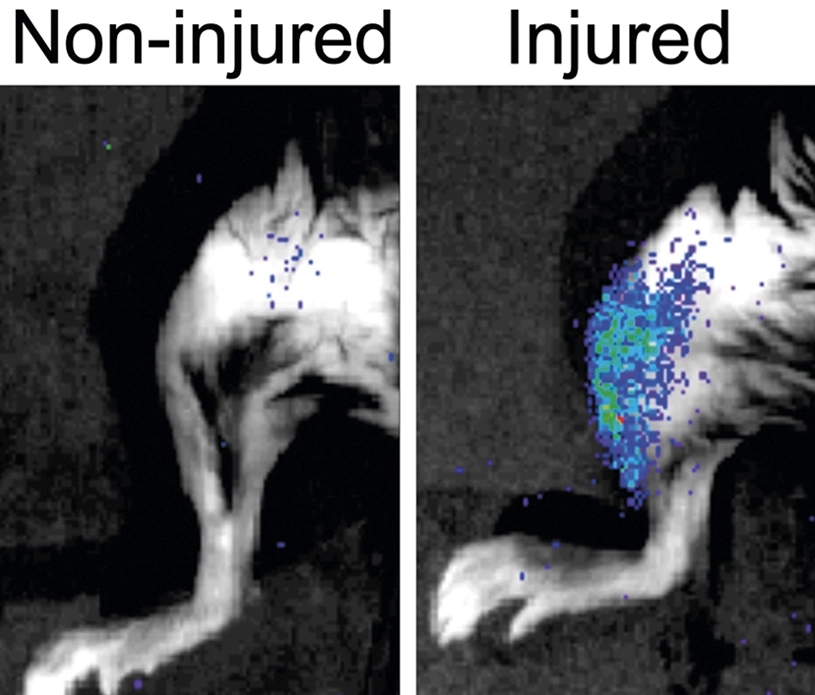
Investigadores de la Universidad Pompeu Fabra (UPF), ICREA, CNIC, CIBERNED y Altos Labs han descrito cómo las células senescentes que inevitablemente aparecen después de una lesión afectan negativamente a la regeneración de los tejidos, y cómo este mecanismo actúa activamente en la vejez, pero sorprendentemente también en la juventud. Esta acción negativa se puede resolver genética y farmacológicamente y, por tanto, se pueden recuperar las funciones regenerativas de las células madre.
La regeneración de los tejidos depende de la población de células madre y sus células vecinas, un proceso cuya eficacia disminuye con el envejecimiento. Las causas de esta disminución son en gran medida desconocidas. Además, se ha descubierto en experimentos realizados con ratones que las células senescentes son nuevos componentes reguladores del nicho de regeneración del tejido muscular que dificultan la regeneración muscular en todas las etapas de la vida. La senescencia celular es un estado de paro irreversible del ciclo celular que a menudo aparece después del daño de los tejidos y en enfermedades relacionadas con la edad.
En un estudio publicado en Nature, el equipo creó el primer atlas transcriptómico de células senescentes del músculo esquelético dañado de ratones de diferentes edades. Los investigadores encontraron que las células senescentes presentan una amplia heterogeneidad, aunque comparten rasgos comunes, incluyendo la secreción de factores proinflamatorios y profibróticos. Esta secreción, a su vez, afecta a las células madre cercanas y dificulta su capacidad regenerativa, perjudicando, pues, la regeneración muscular. Por tanto, parece que lo que antes constituía una buena herramienta de protección ahora se ha convertido en una mala.
Los resultados mostraron que la reducción de la carga de células senescentes (ya sea mediante tratamientos genéticos o farmacológicos que inducen la muerte de estas células) mejoraba la regeneración de los músculos envejecidos y, de forma inesperada, también de los músculos jóvenes. Además de los beneficios biomédicos que implica centrarse en las células senescentes, podría transferirse la nueva información molecular proporcionada por el atlas de células senescentes musculares para comprender la función de la senescencia en otros tejidos cuyas células senescentes no se han descrito en absoluto o carecen de suficientes células senescentes. En el estudio ha participado el grupo de genómica del CNIC que dirige Ana Dopazo.
El estudio se ha financiado en parte con subvenciones del Consejo Europeo de Investigación (ERC), el Ministerio de Ciencia e Innovación español, La Fundación “la Caixa”, AFM, MDA, MWRF y DPP-Spain.
Nature Cell Biology
Un estudio del CNIC desvela que las células tienen dos mecanismos distintos para responder a diferentes rangos de fuerzas

Una investigación realizada en el CNIC puede suponer un cambio de paradigma en el campo de la mecanobiología, ya que desvela que las células tienen dos mecanismos distintos para responder a diferentes rangos de fuerzas, mediados por diminutos hoyuelos en su superficie (caveolas) o grandes depresiones, las “dolinas”.
La investigación que se publicó en NCB, explica Miguel Ángel del Pozo, coordinador de la investigación y jefe de grupo de Mecanoadaptación y Biología de Caveolas del CNIC, resuelve controversias en este campo, “aclarando que el papel de las caveolas resulta esencial en tejidos que están sometidos a grandes fuerzas mecánicas (como músculo, corazón, vasos y adiposo), mientras que el de las dolinas sería relevante para responder a fuerzas bajas o medias”.
Las células, explican los investigadores, están constantemente sometidas a fuerzas mecánicas de diferente tipo e intensidad procedentes de su microambiente, como el flujo sanguíneo, las contracciones o estiramientos musculares, etc. Para responder y adaptar su funcionamiento a estos estímulos, la evolución las ha dotado de elementos y mecanismos capaces de “sentir” o detectar diferentes formas de fuerzas.
Entre todas las estructuras celulares con esta capacidad, las mejor conocidas, señala Miguel Ángel del Pozo, son las caveolas. “Son diminutas invaginaciones de la membrana plasmática (la envuelta externa de las células), presentes en muchos tipos celulares, que detectan estímulos mecánicos al modificar su geometría: se aplanan cuando las células se hinchan o se someten a un estiramiento; y se vuelven a formar y agrupar cuando la membrana celular está relajada”.
Estos cambios, a su vez, añade el Dr. Del Pozo, “modulan redes de señales bioquímicas en la célula, de tal forma que las caveolas no solo son adaptadores mecánicos, sino también transductores de información mecánica”. Sin embargo, antes de este trabajo, no estaba claro si para este proceso es necesaria la invaginación completa o resulta suficiente con alguna de sus piezas, principalmente caveolina-1 y cavina-1.
Para tratar de comprender mejor esta cuestión, los investigadores del CNIC establecieron inicialmente una colaboración con el biofísico de la Universidad de Barcelona-IBEC Pere Roca-Cusachs, para, mediante el uso de la técnica de pinzas magnéticas, “tratar de dilucidar qué elemento es el sensor mecánico y cuál el transductor de la señal”, señala Miguel Ángel del Pozo.
Los resultados de estos experimentos, junto con otras muchas medidas biofísicas, realizadas en colaboración con numerosos laboratorios nacionales e internacionales, permitieron demostrar que células que solo expresaban caveolina-1 —en ausencia de cavina-1— eran capaces de permitir una respuesta mecánica semejante a las células con caveolas.
A continuación, los investigadores trataron de determinar la diferencia funcional entre caveolas y el papel aislado de caveolina-1, “lo cual no resultó una tarea fácil”, comenta el Dr. Fidel Lolo. La respuesta caveolar es on-off (interruptor), que únicamente se activa a partir de un umbral de fuerza alto, y requiere minutos. Sin embargo, las nuevas estructuras responden gradual, continua e inmediatamente (segundos) a rangos de fuerza menores in crescendo.
Por otro lado, el Dr. Lolo sugiere que “las dolinas podrían ser especialmente importantes en células que no tienen caveolas (como linfocitos o neuronas), pero que sí expresan ciertos niveles de caveolina-1, de forma que su fisiología estaría adaptada a responder a fuerzas más sutiles propias del microambiente en el que viven estos tipos celulares”.
La investigación ha contado con las ayudas del Programa de Innovación Unión Europea Horizonte 2020 Investigación a través de la acción estratégica ITN Marie Skłodowska-Curie, del Ministerio de Ciencia e Innovación de España (incluido el Programa Severo Ochoa), la Fundación ”la Caixa” (AtheroConvergence); la Asociación Española Contra el Cáncer, la Fundació La Marató de TV3 y la Comunidad de Madrid (proyecto ‘Tec4Bio’).
















