Excelencia en divulgación científica
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
Nature
Un nuevo mecanismo para el desarrollo de las arterias
Una investigación del CNIC, liderada por Rui Benedito, no solo supuso un gran paso en la comprensión de la biología de los vasos sanguíneos, sino que sus resultados permitirán diseñar mejores estrategias terapéuticas para inducir una vascularización y una perfusión más efectiva en tejidos lesionados o isquémicos. El estudio, que se publicó en Nature, descubrió un nuevo mecanismo celular y molecular que es esencial para el desarrollo de arterias a partir de capilares sanguíneos, un proceso biológico designado como arterialización. La activación de este mecanismo en los tejidos que han sufrido una reducción transitoria o permanente del riego sanguíneo, como ocurre tras un infarto de miocardio, podría mejorar la regeneración y función del tejido cardiaco.
Los resultados tienen importantes implicaciones en cuanto al uso de compuestos farmacológicos dirigidos a estimular la angiogénesis —formación de los vasos sanguíneos— en la enfermedad isquémica cardiovascular.
Así, el trabajo sugiere que los fármacos proangiogénicos que estimulan la proliferación general de vasos sanguíneos suprimirían la arterialización. “La clave ahora será identificar nuevas formas de eliminar las señales de proliferación exclusivamente en las células prearteriales, para así poder inducir una arterialización eficaz al mismo tiempo que se promueve la angiogénesis capilar”, señala Rui Benedito.
Los investigadores concluyen que, desde un punto de vista traslacional, la capacidad de modular la identidad arterial o venosa de los vasos sanguíneos es de gran interés para el tratamiento de la enfermedad arterial coronaria y la isquemia del miocardio. Los resultados pueden permitir una mejor inducción del proceso de arterialización durante el crecimiento o regeneración tisular, o en la enfermedad cardiovascular isquémica.

ELIFE
Los neutrófilos, un eslabón que controla el reloj de nuestro hígado
Investigadoras del CNIC descubrieron un mecanismo a través del cual se desarrolla la esteatosis o hígado graso, uno de los principales factores de riesgo del cáncer de hígado. El estudio, que se publicó en eLife, desveló por primera vez que los neutrófilos actúan como “mensajeros circadianos” en el hígado, controlando su reloj interno y su metabolismo lipídico. El trabajo abre una nueva ventana terapéutica para el tratamiento de enfermedades hepáticas como la esteatosis.
Estos descubrimientos sitúan a los neutrófilos como nuevos miembros activos y cruciales en el control metabólico y circadiano del hígado. Podrían llegar a ser una nueva diana terapéutica para el tratamiento de enfermedades metabólicas como la esteatosis, que suele desencadenar algunos tipos de cáncer hepático.
El estudio contó con la financiación de la Asociación Española Contra el Cáncer (AECC).

Science Advances
Identificado el papel de la proteína CCT en el control de la formación de la sinapsis inmune
Un estudio publicado en Science Advances identificó el papel de la proteína CCT, una chaperonina citosólica, en la reorganización del esqueleto celular que acompaña este proceso. Los investigadores de los grupos de Francisco Sánchez-Madrid y Noa Martín, CNIC, y el Instituto de Investigación Sanitaria del Hospital Universitario de La Princesa (IIS Princesa) y José María Valpuesta, perteneciente al CNB-CSIC, describen cómo CCT controla los cambios en la disposición del centrosoma y las mitocondrias (los orgánulos que producen la energía intracelular) a través de la producción de elementos del citoesqueleto como son la α- y β-tubulina.
Este hallazgo abre la puerta al diseño de estrategias dirigidas a bloquear CCT como terapia frente a procesos autoinmunitarios que cursen con hiperactivación de las células linfoides.
NATURE
Nueva diana diagnóstica y terapéutica para la enfermedad cardiovascular
Un estudio que se publicó en Nature mostró a la proteína mitocondrial ALDH4A1 como un nuevo autoantígeno implicado en los procesos de la aterosclerosis. Los investigadores del CNIC señalan que esta proteína puede convertirse en una futura diana tanto para el diagnóstico como para el tratamiento de la enfermedad cardiovascular.
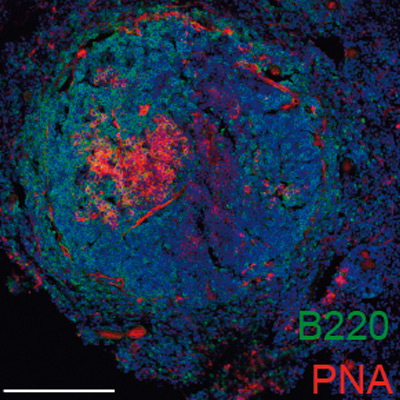
Debido a que la aterosclerosis puede permanecer asintomática durante largos periodos, existe una necesidad de desarrollar nuevas herramientas diagnósticas y terapéuticas. “Sabemos que la aterosclerosis tiene un componente inmunológico y que tanto la inmunidad innata como la adaptativa están implicadas en su inicio y progresión”, señaló la coordinadora del estudio, la doctora Almudena Ramiro. Sin embargo, se desconoce en gran medida la respuesta específica de las células B del sistema inmune y el repertorio de anticuerpos asociado a la aterosclerosis.
Los autoantígenos son moléculas del propio organismo que, por diferentes mecanismos, son reconocidas como extrañas e inducen la aparición de una respuesta inmunitaria. “Esta proteína mitocondrial es registrada por los anticuerpos protectores que se producen durante el desarrollo de la aterosclerosis, lo que la convierte en una posible diana terapéutica, además de una herramienta diagnóstica potencial para esta enfermedad”, destaca Ramiro.
En el estudio se ha visto que ALDH4A1 se acumula en la placa de ateroma y que sus niveles en plasma están aumentados, tanto en los ratones aterogénicos como en pacientes humanos con aterosclerosis carotidea, convirtiéndose en un nuevo posible biomarcador de la enfermedad.
Además, la infusión de anticuerpos A12 en los ratones retrasó la formación de placa y redujo los niveles circulantes de colesterol libre y LDL, lo que sugiere que los anticuerpos anti-ALDH4A1 pueden desempeñar un papel protector en la progresión de la aterosclerosis y podrían tener potencial terapéutico.
Estos resultados amplían el conocimiento sobre la respuesta humoral durante la aterosclerosis y abren la posibilidad a la utilización de ALDH4A1 como un nuevo biomarcador y de A12 como potencial agente terapéutico de esta enfermedad.
El proyecto ha sido financiado por la Fundación “la Caixa”, la Asociación Española Contra el Cáncer (AECC) y el Ministerio de Ciencia, Innovación y Universidades.
Nature Cell Biology
Identifican un subgrupo de células madre que resiste el envejecimiento y mantiene la capacidad de regeneración muscular hasta la edad geriátrica
Investigadores del CNIC, la Universitat Pompeu Fabra, ICREA y Ciberned identificaron un mecanismo fisiológico que mantiene la capacidad regenerativa de las células madre musculares, y que sorprendentemente resiste el paso del tiempo mucho más de lo esperado, hasta la edad geriátrica.
La regeneración del músculo esquelético depende de una población de células madre musculares (células satélite) que se encuentran en un estado latente o quiescente, una situación que puede activarse por daño o estrés para formar nuevas fibras musculares y expandirse en nuevas células madre.
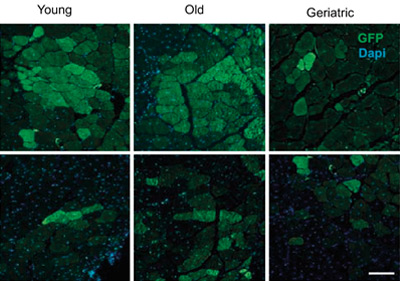
Se sabe que las funciones regenerativas de estas células madre disminuyen con el envejecimiento. La Dra. Pura Muñoz-Cánoves y sus colaboradores, constataron, en experimentos con ratones, que todas las células madre musculares, a pesar de estar en quiescencia, no son iguales, y han identificado un subgrupo que mantiene su capacidad regenerativa a lo largo del tiempo, decayendo solo en la edad geriátrica.
Los investigadores demostraron que este subgrupo de células madre quiescentes poseen una capacidad regenerativa superior a través de la activación de la vía de señalización asociada a FoxO (un factor regulador de la expresión génica previamente asociado a la longevidad), el cual mantiene la expresión de un programa génico joven a lo largo de la vida; sin embargo, en la edad geriátrica, se pierde la activación de FoxO en este subgrupo de células, lo que provoca su pérdida de funcionalidad.
Según los resultados, los fármacos que activen FoxO pueden tener un efecto rejuvenecedor para la musculatura, abriendo la posibilidad de mejorar la salud de personas ancianas debilitadas por la pérdida de masa muscular. También puede ser útil para personas que han perdido masa muscular por enfermedades neuromusculares o por efectos asociados al cáncer o patologías infecciosas o inflamatorias.
El estudio se ha financiado en parte gracias a las ayudas obtenidas de la Fundación “la Caixa”, el European Research Council (ERC) y el Ministerio de Ciencia e Innovación y Universidades.
Cell
El desconocido y reparador efecto de los neutrófilos
El equipo del CNIC que dirige el Dr. Andrés Hidalgo descubrió que los neutrófilos, las células más abundantes de nuestro sistema inmune innato, tienen muchas más funciones en el organismo de las que se pensaba. Este hallazgo abre nuevas posibilidades terapéuticas para el tratamiento de múltiples enfermedades, como el cáncer.
En un estudio publicado en la revista Cell, los investigadores muestran que los neutrófilos adquieren nuevas características cuando acceden a los tejidos. Dichas particularidades ayudan a mantener las funciones vitales de los órganos.
La médula ósea fabrica cada día ingentes cantidades de neutrófilos y, desde ahí, llegan a la sangre y se distribuyen a prácticamente todos los tejidos de nuestro cuerpo. Estas células tienen una vida muy corta, menos de 24 horas, por lo que siempre se ha pensado que su capacidad para adaptarse y adquirir nuevas funciones era muy limitada.
Pero en este estudio se ha encontrado que la incorporación de estas células de la sangre a los tejidos provoca que adquieran propiedades desconocidas anteriormente.
Según el Dr. Hidalgo, lo fascinante es que cada órgano parece adquirir funciones que son útiles para ese tejido en concreto.
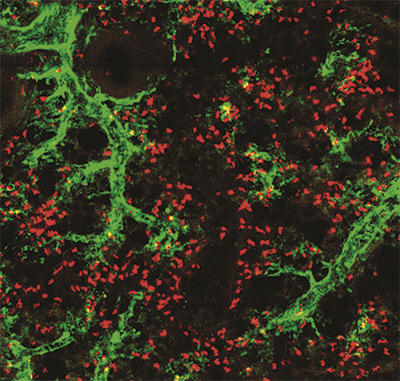
Esta plasticidad para producir cambios en las propiedades de las células se ha identificado en individuos sanos, lo que sugiere que estos leucocitos participan en una gran variedad de funciones normales en nuestro organismo, y que no solo se limitan a luchar contra las infecciones.
La heterogeneidad de los neutrófilos ya había sido identificada en diversas patologías. De hecho, en el caso del cáncer, estos cambios sirven para pronosticar la enfermedad y, en individuos con trasplante medular, ayudar a regenerar el tejido sanguíneo.
Sin embargo, los mecanismos por los que se establece esta hiperplasticidad son aún poco conocidos, por lo que los resultados de este estudio serán clave para entender las bases de dicha heterogeneidad. En esencia, se ha demostrado que, a pesar de tener una vida corta, los neutrófilos pueden cambiar su función y que lo hacen precisamente al entrar a los tejidos. El haber identificado estos cambios permite comprender mejor el papel de distintos tipos de células inmunes en el desarrollo de enfermedades.
Este estudio ha sido financiado por el Fondo Europeo de Desarrollo Regional (FEDER), RTI2018-095497-B-I00, la Fundación “la Caixa” y la Transatlantic Network of Excellence (TNE-18CVD04) de la Leducq Foundation.

Nature Reviews Endocrinology
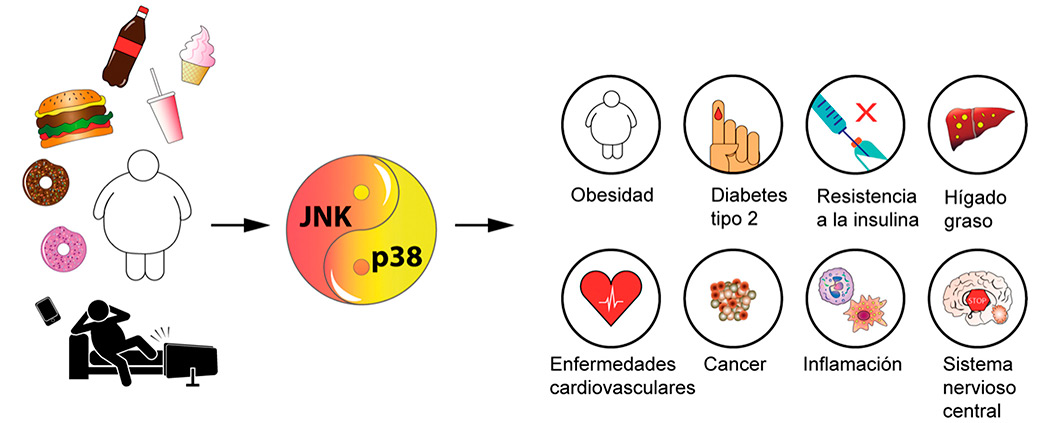
Las proteínas quinasas, la próxima diana para tratar las enfermedades asociadas a la obesidad
Investigadoras del CNIC revisaron, en un artículo que se publicó en Nature Reviews Endocrinology, el papel de unas proteínas, las quinasas de estrés, en el metabolismo.
La revisión señala que existe un grupo de proteínas en el organismo que están asociadas con la obesidad y las alteraciones metabólicas como la resistencia a la insulina o diabetes: son las quinasas activadas por estrés. Determinar sus mecanismos o vías de acción puede ser fundamental para diseñar estrategias terapéuticas para abordar un problema de magnitud mundial como la obesidad, que afecta a millones de personas en todo el mundo.
Se sabe que JNK y p38 funcionan a través de diversas vías o mecanismos de señalización que afectan procesos metabólicos como sensibilidad a la insulina, termogénesis, adipogénesis y lipólisis, o que la activación de SAPK en las células inmunitarias desencadena la inflamación en diferentes tejidos y afecta el metabolismo sistémico en la obesidad. Además, las SAPK tienen funciones específicas de tejido y de sustrato y su activación está involucrada en los trastornos relacionados con la obesidad, esteatohepatitis, cáncer de hígado, insuficiencia cardiaca y diabetes mellitus.
La revisión concluye que el principal objetivo de este campo de investigación es la identificación de inhibidores específicos para cada miembro de las familias p38 y JNK. Estas moléculas permitirían la evaluación de su utilidad terapéutica inhibiendo las quinasas del estrés para la prevención y tratamiento de la obesidad y sus enfermedades asociadas.

El laboratorio cuenta con la financiación de la Fundación Científica de la Asociación Española Contra el Cáncer (AECC), de la Beca Leonardo para Investigadores y Creadores Culturales 2017 de la Fundación BBVA y de la Fundación Europea contra la Diabetes (EFSD).
Science
Descubren un nuevo mecanismo de defensa celular frente a infecciones víricas y bacterianas
Un estudio publicado en la revista Science, en el que participaron investigadores del CNIC, IDIBAPS y la UB, describe un nuevo mecanismo de defensa inmunológica desconocido hasta ahora. Se trata de un mecanismo orquestado por los cuerpos lipídicos (CLs), orgánulos celulares capaces de atraer y eliminar a los patógenos invasores.
Los CLs son los orgánulos donde nuestras células acumulan nutrientes que, en forma de grasa, proporcionan la energía necesaria para que puedan desarrollar su función. Por ejemplo, los CLs suministran la energía para que el corazón pueda latir, el hígado haga su función metabólica o el músculo haga su movimiento.
Esta nueva forma de defensa destaca la íntima relación emergente entre metabolismo e inmunidad, y puede conducir a nuevas estrategias terapéuticas en un momento especialmente crítico, en el que la resistencia a antibióticos constituye un desafío de salud pública mundial creciente.
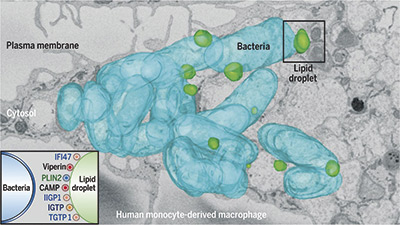
Este trabajo supone un cambio de paradigma, pues hasta ahora se pensaba que los CLs estaban al servicio de los virus o bacterias durante la infección. “En vista de la resistencia generalizada a los antibióticos actuales, este estudio ha descifrado un importante mecanismo de defensa que podría aprovecharse para el desarrollo de nuevas estrategias terapéuticas para frenar las infecciones”, concluyen los autores.
El proyecto ha sido financiado por el Human Frontier Science Program.
Angewandte Chemie International Edition
El control de la velocidad de los motores enzimáticos acerca el uso de nanorobots a su empleo en la biomedicina
Un trabajo del CNIC, la Universidad Complutense de Madrid (UCM), la Universidad de Girona (UdG) y el Instituto de Bioingeniería de Cataluña (IBEC) resolvía uno de los aspectos fundamentales para el uso correcto de los nanorobots basados en lipasas.
El estudio, coordinado por el investigador del CNIC Marco Filice y publicado en la revista Angewandte Chemie International Edition, proporciona una herramienta de modulación de los motores alimentados con enzimas, ampliando así sus posibles aplicaciones tanto en el ámbito biomédico como en el medioambiental.
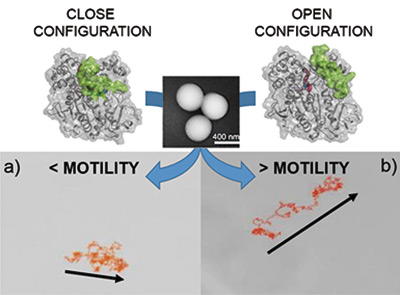
Inspirados por cómo los microorganismos pueden nadar en medios complejos, responder al entorno y organizarse autónomamente, en las últimas dos décadas los científicos han conseguido replicar de forma artificial estos pequeños nadadores desde la escala macro-micro hasta la escala nanométrica, encontrando incluso numerosas aplicaciones como la remediación ambiental y la biomedicina.
De hecho, debido a sus características singulares (rapidez de movimiento, gran capacidad de carga y facilidad de funcionalización de la superficie), los recientes avances en la investigación en este campo han convertido los micro/nanomotores en instrumentos prometedores para solucionar muchos problemas biomédicos. Sin embargo, uno de los elementos clave para la correcta aplicación de estos nanorobots reside en la correcta elección del ‘motor’ que los propulsa.
Este estudio, concluyen sus autores, proporciona una herramienta de modulación de los motores alimentados con enzimas, ampliando así sus posibles aplicaciones tanto en el ámbito biomédico como en el medioambiental.
EHJ
Metoprolol: un fármaco antiguo con propiedades cardioprotectoras únicas
Investigadores del CNIC demostraron las propiedades únicas de metoprolol, un tratamiento capaz de proteger el corazón durante un infarto de miocardio. Metoprolol es un medicamento de la familia de los beta-bloqueantes, empleado en la clínica desde hace más de 40 años, que ha demostrado tener un efecto cardioprotector único.
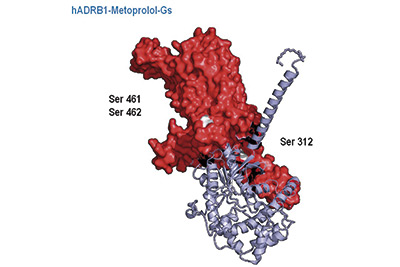
Lo confirmó un trabajo del CNIC, del Hospital Universitario Fundación Jiménez Díaz y del CIBERCV, realizado en sofisticados modelos animales —ratón—, que concluye que el efecto cardioprotector durante un infarto mediado por metoprolol no es compartido por otros fármacos de la familia de los beta-bloqueantes de administración intravenosa habituales en la práctica clínica, como son atenolol y propranolol.
Para el líder del trabajo que se publicó en la revista European Heart Journal, el Dr. Borja Ibáñez, la investigación “demuestra propiedades cardioprotectoras únicas para metoprolol y supone un cambio de paradigma en el campo de la cardiología y el tratamiento del infarto agudo de miocardio”.
La investigación concluye que el metoprolol debe ser un fármaco de elección en la práctica clínica frente a otros miembros de la misma familia. “Si se confirman estos datos en futuros ensayos clínicos, supondrá un cambio en las guías de uso clínico frente a esta devastadora enfermedad, ya que metoprolol, y no otro, debería ser el beta-bloqueante de elección para pacientes que estén sufriendo un infarto”, concluye el Dr. Borja Ibáñez.
JACC
Ejercicio vigoroso, corazón esponjoso
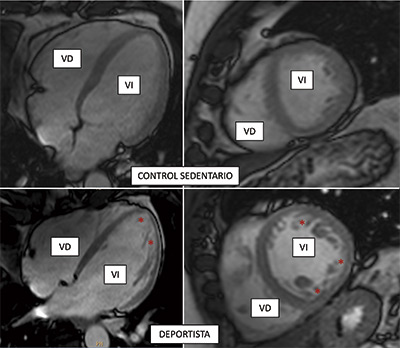
Investigadores del CNIC y miembros del CIBERCV, gracias al empleo de las técnicas de resonancia magnética cardiaca, cuantificaron el fenómeno de hipertrabeculación en una población general (no profesionales del deporte), una información que tiene unas implicaciones prácticas muy importantes, puesto que “el sobrediagnóstico de la miocardiopatía no compactada —la patología maligna— en los deportistas (de élite o amateurs) puede llevar a la decisión de recomendar la interrupción de la actividad física en algunos casos en los que no sería necesario”, explica el Dr. Valentín Fuster, Director General del CNIC.
El trabajo concluye que los criterios de resonancia magnética para diagnosticar la miocardiopatía no compactada no deberían ser evaluados de forma aislada, sino puestos en el contexto de otros parámetros clínicos, pruebas genéticas y el nivel de ejercicio físico, incluso en una población no atlética, para evitar los falsos diagnósticos de esta enfermedad maligna. Un diagnóstico equivocado podría conllevar que la persona tenga que dejar de realizar ejercicio, con las consecuencias deletéreas físicas y psicológicas que ello conlleva.
El estudio, que se publicó en Journal of American College of Cardiology (JACC), forma parte del proyecto colaborativo PESA-CNIC-Santander.
Circulation Research
Un factor fundamental para la correcta formación de las arterias coronarias del corazón
Investigadores del CNIC descubrieron una proteína que participa en la maduración de los vasos del corazón y cuyo déficit durante el desarrollo puede resultar en un remodelado anómalo de las arterias coronarias. El estudio se publicó en Circulation Research y sus hallazgos podrían servir para sentar la base para futuras investigaciones encaminadas a ser explotadas en casos patológicos, para mejorar la regeneración vascular, en condiciones de dolencia coronaria.
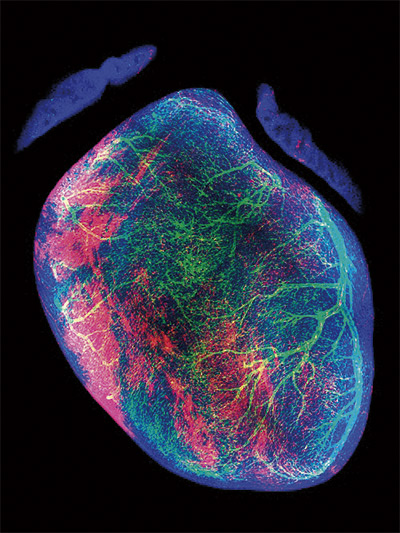
El estudio, llevado a cabo en un modelo de roedor, se ha centrado en el periodo embrionario durante el cual se constituye el árbol vascular coronario, que se encargará de nutrir al músculo cardiaco. El equipo, empleando diversas estirpes de ratones transgénicos y técnicas microscópicas de alta resolución, ha logrado visualizar con un detalle sin precedentes las distintas fases de la vascularización coronaria.
Combinando una paleta bicolor de indicadores genéticos fluorescentes —todos ellos basados en elementos reguladores del gen nestina—, los científicos lograron aislar distintos subtipos de células endoteliales —las células que componen los vasos sanguíneos—, antes y durante el remodelado de la red vascular inmadura.
Al comparar los perfiles moleculares de cada subtipo, el equipo identificó la presencia restringida del factor de transcripción Sox17 en los vasos que estaban siendo sometidos al remodelado arterial. Y cuando eliminaron específicamente en el endotelio coronario dicha proteína, durante la fase de remodelado, se obtuvo un fenotipo coronario muy severo, principalmente caracterizado por una formación defectuosa de la arteria coronaria izquierda.

JACC
El algoritmo que personaliza el riesgo cardiovascular en personas sanas
Investigadores del CNIC diseñaron un algoritmo que personaliza el riesgo cardiovascular de individuos de mediana edad y sanos, en función de su edad, tensión arterial, dieta y marcadores medibles en análisis de sangre y orina. El algoritmo, denominado EN-PESA, podría servir como una herramienta económica y fácil para calcular el grado de aterosclerosis subclínica —caracterizada por el depósito de sustancias lipídicas en las paredes de las arterias—, especialmente para las personas con un mayor riesgo. Según los investigadores, “contribuirá a personalizar más el riesgo cardiovascular, lo que se traducirá en tratamientos y planes de seguimiento más personalizados”. El estudio se publicó en Journal of American College of Cardiology (JACC).
El éxito de estos algoritmos se basa en el uso de grandes cantidades de datos recolectados y procesados de manera sistemática en un alto número de individuos, como los del proyecto colaborativo PESA-CNIC-Santander, cuyo investigador principal es el Dr. Valentín Fuster.
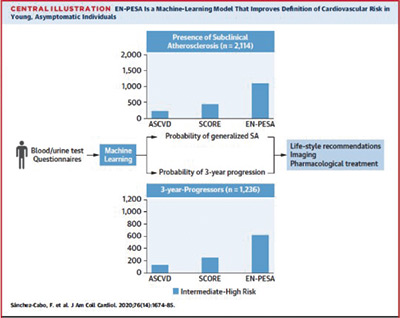
El algoritmo ha seleccionado la información obtenida a partir de esta ingente cantidad de datos para identificar un pequeño conjunto de variables fácilmente medibles en atención primaria. Estas variables permiten predecir la extensión de aterosclerosis subclínica y la progresión de la enfermedad vascular en individuos de mediana edad sanos que habían sido clasificados de riesgo bajo o intermedio según las escalas tradicionales de riesgo cardiovascular.
Los parámetros incluyen la edad, presión arterial e información recogida de manera rutinaria en análisis de sangre y orina y en cuestionarios dietéticos.
Los investigadores concluyen: “Gracias a este algoritmo se puede mejorar el manejo clínico de personas aparentemente sanas y con un bajo riesgo cardiovascular según los marcadores tradicionales, pero que presentan una extensión generalizada de aterosclerosis subclínica o una probabilidad alta de que la enfermedad progrese significativamente a corto plazo”.
Nature Metabolism
El mecanismo por el que el metabolismo de las células inmunitarias regula la obesidad
Investigadores del CNIC mostraron cómo se regulan los macrófagos en un trabajo que se publicó en Nature Metabolism, que podría servir para diseñar nuevos tratamientos para la obesidad y el sobrepeso, y para algunas patologías asociadas como el hígado graso o la diabetes tipo 2.
El estudio, liderado por el Dr. José Antonio Enríquez y el Dr. David Sancho, explica cómo la activación del metabolismo mitocondrial de los macrófagos que se produce en respuesta al estrés oxidativo generado por exceso de nutrientes contribuye a la inflamación del tejido adiposo y a la obesidad.
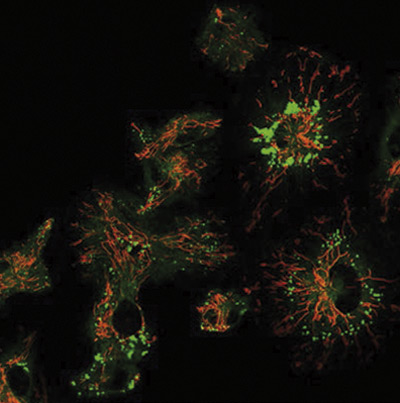
La investigación ha analizado cómo los cambios metabólicos en los macrófagos regulan este proceso inflamatorio que subyace a la obesidad y el síndrome metabólico. Los nuevos hallazgos revelan cómo la detección de señales de peligro oxidativo, conocido como especies reactivas de oxígeno, por parte de los macrófagos, induce cambios en el metabolismo mitocondrial de dichas células inmunitarias que son necesarios para su diferenciación a un tipo proinflamatorio M1. Este estrés oxidativo está presente en los pacientes con obesidad mórbida y parece estar relacionado con la dieta rica en grasas, frecuente en la inadecuada dieta occidental.
Una de las conclusiones de este estudio es que demuestra que, si se reduce dicho estrés oxidativo, se atenúan algunos de los parámetros perjudiciales asociados a la obesidad.
Los investigadores concluyen que sus datos sugieren la posibilidad de emplear inhibidores específicos de la proteína Fgr como tratamiento para los pacientes obesos y/o con síndrome metabólico, con el objetivo de reducir la inflamación asociada y mejorar así los parámetros asociados con estas patologías, como el hígado graso o la diabetes tipo 2, contribuyendo así a aumentar su esperanza y calidad de vida.
El estudio contó con la financiación de la International Human Frontier Science Program Organization (HFSP RGP0016/2018).
Cell
Descubren un sistema de limpieza celular clave para mantener el corazón sano
Dos grupos del CNIC, dirigidos por el Dr. Andrés Hidalgo y el Dr. José Antonio Enríquez, descubrieron un sistema de limpieza celular que es clave para mantener el corazón sano. Se trata de un mecanismo por el cual las células contráctiles del corazón, los cardiomiocitos, liberan componentes dañados fuera de la célula dentro de unas partículas denominadas exoferas. Estas exoferas son capturadas por una red de células inmunitarias que viven en el tejido cardiaco, los macrófagos, que se encargan de eliminarlas antes de que generen problemas inflamatorios en el corazón.
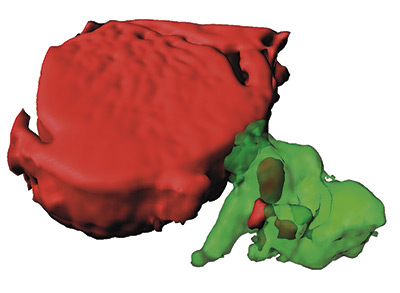
El estudio, que se publicó en Cell, recoge los resultados de más de cinco años de investigación y colaboraciones con diversos laboratorios de Europa, Asia y EE.UU. La información que aporta este descubrimiento sugiere que la disfunción cardiaca puede, en algunos casos, emanar de defectos en estas células inmunes residentes en lugar de los cardiomiocitos, un concepto con importantes consecuencias para el diagnóstico y tratamiento de la enfermedad cardiaca.
El hecho de que los cardiomiocitos subroguen la eliminación de sus desechos a los macrófagos es un descubrimiento que tiene múltiples implicaciones. Así, asegura el Dr. Enríquez, “que el corazón precise de una población de macrófagos para desempeñar, entre otras cosas, labores de limpieza, sugiere que muchas enfermedades cardiacas con causa desconocida pueden tener su explicación en fallos de estos macrófagos”.
Otra implicación sería la posible existencia de procesos similares para mantener la calidad de células especializadas en otros tejidos, como el cerebro, cuyas células comparten características similares a las del corazón.
El trabajo concluye que la identificación de la eliminación activa de mitocondrias derivadas de cardiomiocitos y otro material por los macrófagos establece un paradigma de cómo los fagocitos residentes contribuyen al mantenimiento general de los tejidos.
JACC
Nuevos datos sobre la eficacia de los anticoagulantes en pacientes con COVID-19
Los anticoagulantes pueden mejorar la supervivencia de los pacientes hospitalizados con COVID-19 al prevenir posibles eventos mortales asociados con el coronavirus, como infartos o ictus. Según un estudio que se publicó en JACC, dirigido por el Dr. Valentín Fuster, Director del CNIC y del Instituto Mount Sinai Heart de Nueva York, las personas hospitalizadas con COVID-19, la enfermedad que causa el SARS-CoV-2, tratados con anticoagulantes —fármacos que previenen la coagulación de la sangre— pueden mejorar sus posibilidades de supervivencia.
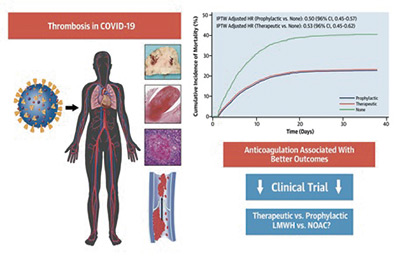
El equipo evaluó los registros médicos electrónicos de 4.389 pacientes positivos de COVID-19 confirmados ingresados en cinco diferentes hospitales entre el 1 de marzo y el 30 de abril de 2020. En concreto, analizaron las tasas de supervivencia y mortalidad de los pacientes que recibieron dosis terapéuticas y profilácticas de anticoagulantes (antitrombóticos orales, heparina de bajo peso molecular subcutánea y heparina intravenosa) en comparación con los que no recibieron estas terapias.
Un total de 467 pacientes (10,6%) requirió intubación y ventilación mecánica durante su hospitalización. Los que tomaban anticoagulantes terapéuticos tenían un 31% menos de intubaciones que los que no recibían estos fármacos, mientras que los que fueron tratados con anticoagulantes profilácticos tenían un 28% menos de probabilidad de ser intubados. La diferencia entre los dos grupos de anticoagulantes no fue estadísticamente significativa.
Nature
Descifran un mecanismo clave en la hipoxia
Una investigación del CNIC y del Instituto de Investigación Sanitaria Princesa descifró, en gran parte, el mecanismo por el cual se incrementa la producción de especies reactivas de oxígeno (ROS) en las etapas tempranas de la hipoxia —disminución aguda de oxígeno—, una información clave para avanzar en el conocimiento de la fisiología celular y que podría ser usada para futuras terapias para el tratamiento de las distintas patologías en las que la hipoxia está involucrada, como un ictus o un paro cardiaco. El estudio se publicó en Nature.
El trabajo determinó que el sodio (Na++) que entra en las mitocondrias actúa como un segundo mensajero regulando la función de la mitocondria —en concreto de la cadena de transporte electrónico mitocondrial (CTM)—, causando la producción controlada de ROS.
Este mecanismo, a través de la producción de ROS, es fundamental para la adaptación de la circulación sanguínea pulmonar a situaciones de hipoxia mediante la redistribución del flujo de sangre a zonas menos ventiladas, un fenómeno llamado vasoconstricción pulmonar hipóxica.
Varios aspectos de esta investigación son claves para la fisiología celular. Primero, la capacidad del sodio mitocondrial de regular la fluidez de membranas celulares, un aspecto desconocido hasta el momento y que podría tener grandes implicaciones en la regulación de multitud de procesos celulares.
Segundo, la relevancia en este proceso de los supercomplejos mitocondriales, generando estructuras sensibles o insensibles al sodio dentro de la cadena de transporte electrónico mitocondrial, permitiendo que la acción del sodio no sea tóxica.
Por último, el trabajo demuestra que la inhibición del intercambiador mitocondrial de sodio/calcio (NCLX) es suficiente para bloquear esta vía, evitando la adaptación a la hipoxia. Este hecho podría ser usado como terapia para las distintas patologías en las que la hipoxia está involucrada.
Los resultados revelan que el sodio controla la función OXPHOS y la señalización celular en hipoxia a través de una inesperada interacción con fosfolípidos, con profundas consecuencias en el metabolismo celular.

La investigación ha contado con la financiación de la International Human Frontier Science Program Organization (HFSP RGP0016/2018).
Science Advances
Describen los mecanismos responsables de la competencia entre genomas mitocondriales cuando conviven en la misma célula
Una investigación, realizada por investigadores del CNIC, describió los mecanismos responsables de la competencia entre genomas mitocondriales cuando conviven en la misma célula. El trabajo, publicado en Science Advances, estudió por qué la presencia simultánea de más de un tipo de ADN mitocondrial en las células es rechazada por la mayoría de los tejidos, que seleccionan una única variante que es diferente según cada tejido.
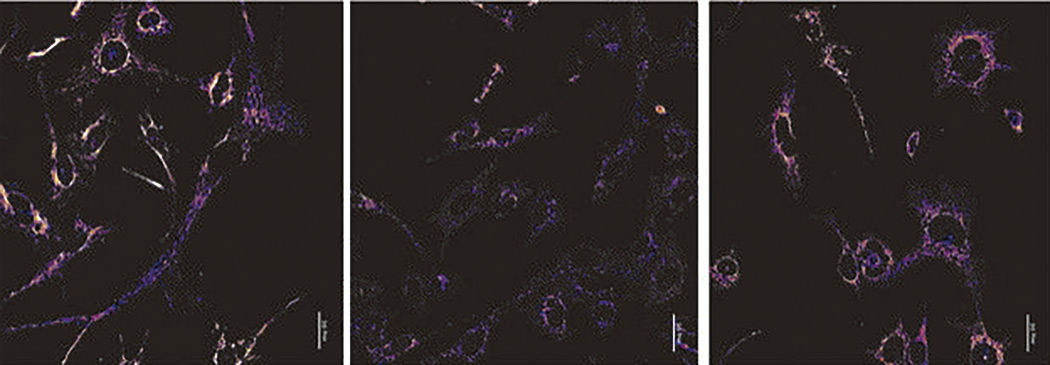
El estudio revela que la célula es capaz de reconocer y seleccionar de forma específica las mitocondrias con uno u otro ADN mitocondrial, lo que les otorga sutiles diferencias funcionales que las hacen más o menos eficientes para distintos tipos de células dependiendo de sus necesidades metabólicas. Esto explica que el ADN mitocondrial preferido sea diferente en distintos tipos celulares.
Con esta investigación, se ha esclarecido que la selección del ADN mitocondrial depende del tipo celular y no del tipo de tejido, como se creía hasta el momento.
Además, añaden los investigadores, el estudio ha definido dianas moleculares para desarrollar herramientas que modularían la selección del ADN mitocondrial y metabolismo celular como medio para prevenir la generación de heteroplasmia accidental derivada de nuevas tecnologías médicas, entre las que se encuentra el trasplante de mitocondrias sanas para prevenir enfermedades mitocondriales, la inyección de mitocondrias en ovocitos para incrementar la fertilidad, o la propuesta de transferir mitocondrias entre células como opción terapéutica en diversas patologías (cardiovasculares, pulmonares o nerviosas) utilizando técnicas de terapia celular.
El estudio ha contado con la financiación de la International Human Frontier Science Program Organization (HFSP RGP0016/2018).
PNAS
Descubren un nuevo mecanismo que controla la aparición del cáncer de hígado
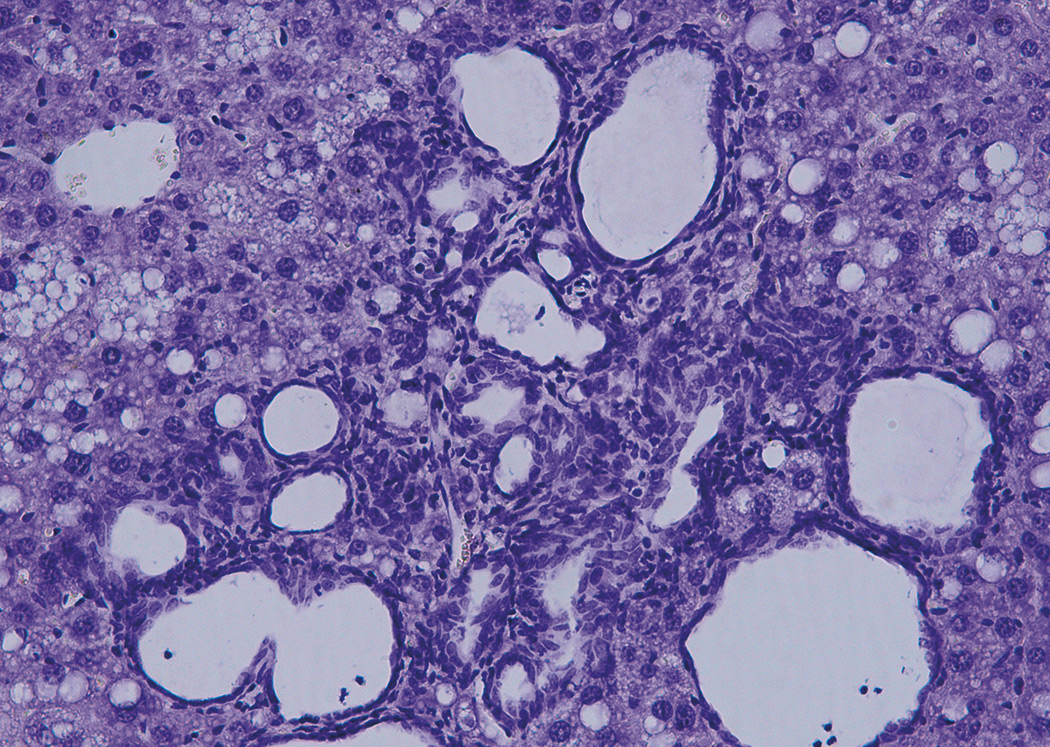
Investigadores del CNIC descubrieron un mecanismo que controla la aparición de un tipo de cáncer de hígado. El estudio, que se publicó en PNAS, identificó una proteína que, al ser bloqueada, reduce drásticamente la incidencia y la progresión de este tipo de cáncer, denominado colangiocarcinoma. Este trabajo ha sido posible debido a que los investigadores del CNIC han desarrollado un modelo animal en el que alteraciones en la producción de ácidos biliares causan este tipo de tumor.
En el estudio, dirigido por Guadalupe Sabio y Alfonso Mora, se generó un tipo de ratones cuyo hígado no contiene las proteínas JNK1 y JNK2. Los investigadores vieron que estas dos proteínas controlan la producción de ácidos biliares en el hígado, esenciales para la digestión adecuada de las grasas y la absorción de las vitaminas liposolubles (A, D, E y K). “La ausencia en el hígado de JNK1 y JNK2 provoca cambios en las enzimas encargadas del metabolismo del colesterol y de los ácidos biliares —señala el Dr. Mora—. En los ratones analizados, hemos observado un exceso de ácidos biliares en sangre”.

Utilizando este modelo, los investigadores han sido capaces de encontrar una proteína que es esencial en este proceso tumoral, PPARα. Esta proteína regula el metabolismo de ácidos biliares y de lípidos del hígado. Aquellos ratones que carecen de PPARα “presentan un número de tumores mucho menor. Casi la mitad de ellos, ninguno”.
Aunque todavía se desconoce si estos datos pueden ser extrapolables a personas, la existencia de este primer modelo animal va a permitir el estudio de un tipo de tumor que todavía solo se puede diagnosticar en fases muy avanzadas y cuando las metástasis ya se han producido.
Estudios previos habían mostrado que el bloqueo de la JNK impedía el desarrollo de esteatosis en el hígado. A raíz de estos resultados, se iniciaron varios ensayos clínicos con inhibidores de estas proteínas.
Los investigadores concluyen que los nuevos hallazgos suponen una “llamada de atención” sobre estos fármacos.
El estudio ha contado con la financiación de la AECC y de la Beca Leonardo para Investigadores y Creadores Culturales 2017, concedida por la Fundación BBVA.
Science Advances
Explican cómo la mitocondria regula la producción de energía
Investigadores del CNIC descubrieron el mecanismo molecular por el que la mitocondria —la fuente energética de las células— regula su funcionamiento para adaptar de forma óptima la producción de energía a las necesidades del organismo. El descubrimiento, que se publicó en la revista Science Advances, ayuda a entender cómo se regula nuestro metabolismo.
En el estudio, dirigido por los investigadores del CNIC Jesús Vázquez y José Antonio Enríquez, se demostró que la cadena de transporte de electrones de la mitocondria ajusta su eficiencia energética para adaptarse a las necesidades del organismo a través de la asociación regulada de sus estructuras macromoleculares. Además, se mostró que la proteína SCAF1, descubierta por este mismo equipo en 2016, es un factor clave en la regulación del metabolismo energético, optimizando la eficiencia de la mitocondria ante altas demandas de energía.
Según los investigadores, estos resultados demuestran que la asociación física entre los complejos CIII y CIV, mediada por SCAF1, es determinante para que la mitocondria produzca energía de forma óptima. SCAF1 actúa como un factor regulador que permite a la mitocondria adaptarse a la fuente nutricional disponible de azúcares, grasas o proteínas. Esta habilidad de adaptación metabólica explica, además, la capacidad que tiene la mitocondria de adaptarse a situaciones de estrés como las producidas por un ejercicio físico intenso.
El estudio contó con la financiación de la International Human Frontier Science Program Organization (HFSP RGP0016/2018), la Fundació La Marató de TV3 y la Fundación “la Caixa”.

Science Advances
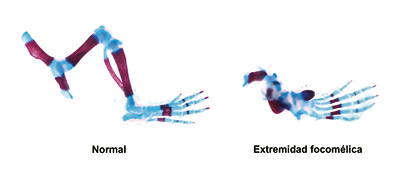
Un sistema esencial para la formación correcta de las extremidades en el embrión

Un estudio publicado en Science Advances desveló un sistema que proporciona información a las células del embrión sobre la posición que ocupan en órganos en formación. El sistema, estudiado en su función en la formación de las extremidades, permite a las células interpretar qué partes de la anatomía del órgano les corresponde formar. El artículo indica, asimismo, que un mal funcionamiento de dicho sistema conduce a malformaciones congénitas y podría explicar, en parte, el efecto de la talidomida, fármaco conocido por producir una alta incidencia de malformaciones de las extremidades.
El equipo del CNIC, en colaboración con investigadores de los Institutos Nacionales de Salud de EE.UU. (NIH), analizó las bases moleculares de la formación de las extremidades. De esta forma, logró descifrar cómo obtienen las células información acerca de su posición en el eje próximo-distal de los primordios (estado rudimentario en que se encuentra un órgano en formación) de las extremidades.
Se ha identificado un factor de crecimiento, llamado FGF, como la señal que reciben las células para interpretar su posición. La señal se modula en función de la cercanía o lejanía (proximal/distal).
Asimismo, los investigadores lograron identificar una molécula que tiene la función de interpretar las señales de FGF en las células receptoras. Se trata del factor de transcripción denominado Meis, que interpreta las señales de FGF y que se distribuye en un gradiente lineal de abundancia.
Este sistema descubierto, destacó Miguel Torres, coordinador del estudio, “es esencial para la formación correcta de las extremidades”. Los mecanismos descritos, además, son relevantes para avanzar en el entendimiento del origen genético de la focomelia, una anomalía congénita en la que se desarrollan solo las manos y los pies, mientras que el resto de la extremidad es rudimentario. En este estudio, al eliminar experimentalmente el sistema de información posicional descubierto, todas las células del primordio de la extremidad recibían la información errónea de que eran distales, lo cual produjo focomelia.
Estos hallazgos establecen un nuevo modelo para la generación de identidades de proximal a distal en las extremidades de vertebrados y proporcionan una base molecular para la interpretación de los gradientes de señal del factor FGF durante la formación de patrones axiales en el embrión de vertebrados.
Science
Descubren que las células inmunes envejecidas o estresadas pueden dañar tejidos y acelerar patologías asociadas a la edad
Científicos del Instituto de Investigación del Hospital Universitario 12 de Octubre (i+12) y el Centro de Biología Molecular (CBM) Severo Ochoa, en colaboración con investigadores del CNIC, demostraron que un sistema inmune envejecido o estresado puede atacar a los tejidos del mismo organismo y acelerar la aparición de diversas enfermedades asociadas a la edad.
Publicado en la revista Science, los resultados ponen en evidencia que, cuando los linfocitos T envejecen o se estresan, desencadenan una gran tormenta de citoquinas que puede alcanzar diferentes tejidos y órganos, induciendo en ellos la activación de un programa de envejecimiento celular que se conoce como senescencia. La aparición de células senescentes en diferentes tejidos provoca una predisposición a padecer diversas patologías, como enfermedades cardiovasculares, neuroinflamatorias, metabólicas o musculares.
El hallazgo más llamativo ha consistido en comprobar que los ratones con su sistema inmune estresado, con el paso del tiempo, tenían aspecto de envejecer prematuramente y desarrollaban distintos tipos de patologías. Concretamente, presentaban en un principio alteraciones cardiovasculares y perdían peso. Posteriormente, perdieron fuerza muscular y, por último, presentaron alteraciones en la memoria y en el comportamiento.
En una segunda parte del estudio, este grupo se propuso identificar algún tratamiento que pudiera retrasar la aparición de varias de estas patologías. Utilizaron para ello dos estrategias diferentes: una, bloqueando una de las citoquinas de la tormenta que lanza el sistema inmune; y otra, previniendo la senescencia en los distintos tejidos. Ambas estrategias retrasaron la aparición de alguna de estas enfermedades.

JACC
Los anticoagulantes pueden mejorar la supervivencia de los pacientes hospitalizados con COVID-19
Los anticoagulantes pueden mejorar la supervivencia de los pacientes hospitalizados con COVID-19 al prevenir posibles eventos mortales asociados con el coronavirus, como infartos o ictus. Según un estudio publicado en JACC, dirigido por el Dr. Valentín Fuster , Director del CNIC, las personas hospitalizadas con COVID-19, la enfermedad que causa el SARS-CoV-2, tratadas con anticoagulantes —fármacos que ralentizan la coagulación de la sangre— pueden mejorar sus posibilidades de supervivencia.
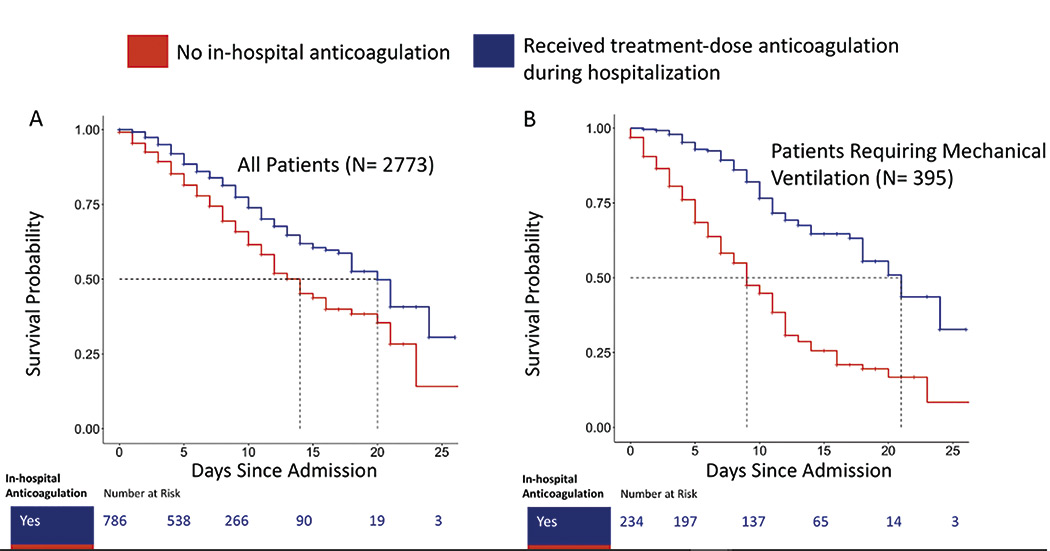
Al inicio de la pandemia, estos investigadores demostraron que la terapia de anticoagulación se asociaba con una mejor supervivencia entre los pacientes hospitalizados con COVID-19. En este nuevo estudio observacional, vieron que los pacientes que recibieron tanto una dosis ‘terapéutica’ o completa como una dosis ‘profiláctica’ o más baja de anticoagulantes tuvieron cerca de un 50% más de posibilidades de supervivencia y, aproximadamente, un 30% menos de posibilidades de intubación que los que no tomaban anticoagulantes.
En el trabajo, coordinado por el Dr. Fuster, se analizaron seis regímenes anticoagulantes diferentes. De todos ellos, la heparina de bajo peso molecular terapéutica y profiláctica y el apixaban terapéutico lograban los mejores resultados.
Cardiovascular Research
El mecanismo que emplea el virus de la gripe para provocar daño cardiaco
Un trabajo liderado por investigadores del CNIC, y que contó con la participación del CSIC, CIBERES, CIBERCV y el Hospital Clínico San Carlos, describió la fisiopatología cardiaca asociada a la infección por el virus de la gripe (especialmente en un virus muy patogénico en humanos), que puede derivar en muerte prematura. Los investigadores mostraron que la infección y replicación del virus en el corazón produce un fallo en la transmisión del impulso eléctrico cardiaco, que puede desembocar en la muerte. Los resultados, publicados en Cardiovascular Research, destacan la potencial relevancia de la detección temprana del virus de la gripe en casos clínicos con daño cardiaco agudo durante las temporadas o brotes de gripe.
El trabajo evaluó los mecanismos relacionados con el daño cardiaco en la infección por el virus de la gripe in vivo en un modelo de ratón y en células musculares cardiacas derivadas de células humanas pluripotentes. A nivel molecular, los resultados encontrados en células musculares cardiacas derivadas de células humanas pluripotentes indican que el virus más patogénico permanece más tiempo en el corazón y produce alteraciones, como la modificación de los canales iónicos que son responsables de la transmisión del impulso eléctrico cardiaco, lo que apoya la muerte prematura encontrada en estos animales. También destacan la relevancia de la detección temprana del virus de la gripe en casos clínicos con enfermedad cardiaca aguda durante los brotes de gripe, que permitiría un diagnóstico y tratamiento precoz de estos pacientes.
“Estos hallazgos alertan sobre la necesidad de identificación precoz del virus en pacientes con afectación cardiaca aguda durante los periodos de gripe”, concluyen los autores.
Nature Communications
Diseñan un modelo de ratón para estudiar la función mecánica de las proteínas In vivo
El laboratorio de Mecánica Molecular del Sistema Cardiovascular del CNIC, dirigido por Jorge Alegre Cebollada, en colaboración con un equipo científico internacional, desarrolló el primer modelo de ratón que permite estudiar de forma directa la función mecánica de las proteínas en organismos vivos.

El modelo, que se publicó en la revista Nature Communications, se basa en la inserción en la proteína titina, una de las responsables de la elasticidad del músculo esquelético y cardiaco, de un módulo llamado HaloTag-TEV, que aúna tres funcionalidades, explicó el Dr. Alegre. “Gracias a este módulo que introducimos en el gen podemos, por un lado, marcar fluorescentemente la proteína, con lo que resulta sencillo seguir dónde dicho módulo se ha insertado correctamente”.
Pero, además, incluye una diana para el corte específico de la proteína, lo que posibilita interrumpir su función mecánica en un momento dado de manera controlada y estudiar, a continuación, las consecuencias directamente derivadas de esa interrupción. Por último, confiere a la proteína un punto de anclaje a superficies que facilita su posterior estudio, una vez aislada, por medio de técnicas de molécula individual.
“Todo ello contribuye a establecer por primera vez un puente entre la modulación de las propiedades mecánicas de proteínas y sus consecuencias a nivel celular”, destacó el Dr. Alegre.
El módulo HaloTag-TEV es aplicable a otras proteínas con función mecánica, con lo que en un futuro podrá utilizarse para estudiar otros sistemas, incluyendo algunos relacionados con diversas enfermedades musculares y del corazón.

JACC
Identifican un biomarcador que detecta la existencia de aterosclerosis antes de tener síntomas
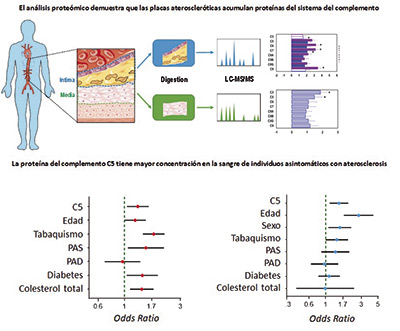
Investigadores del CNIC, del Instituto de Investigación Sanitaria-Fundación Jiménez Díaz (IIS-FJD) y del CIBERCV demostraron que una de las proteínas presentes en la placa de ateroma, en sus estados más iniciales, podría usarse como biomarcador para detectar la aterosclerosis en la fase subclínica, antes de que se presenten los primeros síntomas.
El estudio, publicado en Journal of American College of Cardiology (JACC), concluye que la activación del sistema del complemento es uno de los cambios moleculares más característicos en las primeras etapas del desarrollo de la placa aterosclerótica. Además, muestra que los niveles plasmáticos de la proteína del complemento C5 podrían utilizarse para identificar a aquellas personas que presentan aterosclerosis subclínica de una forma no invasiva y con un coste económico menor.
“Esta identificación precoz serviría para seleccionar a aquellos individuos en los que estaría recomendado realizar pruebas con técnicas de imagen más costosas, para evaluar su riesgo cardiovascular de forma más precisa”, señaló el Dr. Jesús Vázquez, jefe del Laboratorio de Proteómica Cardiovascular del CNIC y uno de los coordinadores del estudio.
En el artículo han participado la Comunidad de Madrid (Complemento II-CM, S2017/BMD-3673) y la Fundación “la Caixa” (HR17-00247).
JACC
La aterosclerosis progresa de forma rápida en personas sanas a partir de los 40 años
Casi la mitad de las personas aparentemente sanas de entre 40 y 50 años podría estar desarrollando una acumulación de placas de grasa —ateroma— en las arterias y de una forma mucho más rápida de lo que se pensaba hasta ahora. La revista JACC publicó nuevos datos del estudio PESA-CNIC-Santander que demuestran que las placas de ateroma se extienden rápidamente por las arterias de sujetos asintomáticos en el 40% de las personas entre 40 y 50 años.
Los investigadores del CNIC, dirigidos por el Dr. Valentín Fuster, Director del CNIC, vieron, además, que la progresión de la aterosclerosis está directamente relacionada con los factores tradicionales de la enfermedad cardiovascular: edad, sexo, hipertensión, colesterol, tabaco y diabetes.
Los investigadores concluyen que estos hallazgos, aunque deben ser validados en un futuro próximo con la presencia de eventos en la cohorte del PESA, son de gran valor para identificar estrategias que permitan prevenir la epidemia de la enfermedad cardiovascular.
Nature Communications
Descubren nuevos mecanismos moleculares que regulan las células centinela del sistema inmune
Publicado en Nature Communications, el estudio sugiere la posibilidad de regular el número y la actividad de estos macrófagos mediante la utilización de fármacos que modulan la actividad del receptor nuclear RXR. Los investigadores del CNIC, en colaboración con el Hospital Mount Sinai de Nueva York (EE.UU.), descubrieron un nuevo mecanismo molecular mediado por receptores nucleares que determina la identidad y expansión de una de las células que trabajan como centinelas de la salud, los macrófagos. En concreto, este nuevo mecanismo afecta a los macrófagos residentes en las cavidades serosas —membranas que recubren y protegen algunos órganos—. La información podría tener importantes repercusiones para el tratamiento de algunas enfermedades que afectan a las cavidades serosas y a los órganos que contienen, como es el caso del cáncer o el infarto de miocardio.
Existen tres membranas serosas: el peritoneo, que tapiza la cavidad abdominal; la pleura, que rodea los pulmones, y el pericardio, en torno al corazón. “Una de las principales funciones de los macrófagos residentes en estas cavidades es mantener la homeostasis mediante la eliminación de células muertas”, explica la Dra. Mercedes Ricote, coordinadora del estudio. Además, estudios recientes han demostrado que estos macrófagos son capaces de infiltrar órganos adyacentes que han sufrido un daño, “generando una respuesta reparativa rápida, efectiva e independiente del reclutamiento de precursores de macrófagos por vía vascular”, señala.
En el estudio se ha demostrado que la expansión de los macrófagos peritoneales tras el nacimiento, así como su mantenimiento durante etapas de la vida adulta, son procesos controlados por un miembro de la familia de receptores nucleares, el receptor X de retinoides (RXR).
Utilizando modelos de cáncer de ovario en ratón, la investigación muestra que los macrófagos peritoneales son capaces de infiltrar tumores de ovario y actuar como ‘macrófagos asociados a tumor’, “favoreciendo así el crecimiento tumoral”, explica la Dra. Ricote.
Los hallazgos, asimismo, demuestran que la pérdida de función de RXR causa una disminución en el número de macrófagos de la cavidad peritoneal y, por tanto, un menor aporte de dichos macrófagos a los tumores ováricos en crecimiento, que tiene como consecuencia una disminución en la progresión de la enfermedad.
Las científicas destacan que su trabajo sugiere la posibilidad de modular la actividad de RXR mediante el uso de fármacos, alguno de ellos empleado en la actualidad para el tratamiento de linfomas cutáneos. “Nuestra investigación podría tener implicaciones terapéuticas en patologías en las que los macrófagos que residen en las cavidades serosas pueden contribuir al desarrollo de la enfermedad, como el cáncer, o actuar reparando los tejidos afectados, como el infarto de miocardio”, concluyen.
Journal of Experimental Medicine
Identifican por primera vez un circuito de regulación inmunológica que podría ser clave en el desarrollo de patologías inflamatorias oculares
Un equipo del CNIC identificó por primera vez un circuito de regulación inmunológica ocular controlado por un subtipo de células endoteliales, las células que recubren el interior de los vasos sanguíneos. El hallazgo ha sido posible gracias al análisis de la expresión génica de 8.000 células de la coroides —la membrana situada en la parte posterior del ojo, entre la retina y la esclerótica—. Los resultados del trabajo, que se publicaron en Journal of Experimental Medicine, no solo abren nuevas perspectivas para el estudio de enfermedades vasculares de la retina y de patologías inflamatorias que afectan a la coroides, sino también para su tratamiento.
La investigación aporta información muy valiosa para comprender cómo las células endoteliales de la coroides pueden regular la aparición de patologías inflamatorias y enfermedades vasculares en la retina. Los autores analizaron la coroides del ratón adulto mediante una técnica denominada ‘single cell RNAseq’, que permite el análisis de la expresión génica de miles de células de manera individual y simultánea.
Nature Immunology
Los neutrófilos contienen un programa de ‘desarme’ que evita que el sistema inmune se ‘descontrole’
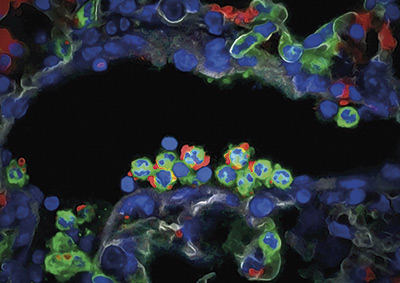
Investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC) descubrieron un mecanismo de ‘desarme’ que protege a nuestro cuerpo de la acción descontrolada del sistema inmune. Este nuevo sistema de control inmune se localiza en unas de las células más importantes del sistema inmunológico: los neutrófilos. La información, que se publicó en Nature Immunology, puede tener importantes repercusiones sobre algunas enfermedades, como el infarto de miocardio, el ictus o los procesos inflamatorios agudos.
El trabajo identificó un programa intrínseco a las células que modifica el proteoma de los neutrófilos en la circulación y causa la pérdida progresiva del contenido tóxico de los gránulos y la reducción de la capacidad de formación de NETs; es decir, de los principales mecanismos ofensivos del neutrófilo. Dicho programa está impulsado por el receptor CXCR2 y por los reguladores de los ritmos circadianos.
Los hallazgos muestran que los neutrófilos poseen “un sistema que, de forma natural, disminuye paulatinamente su capacidad tóxica a lo largo del tiempo, de manera que, según envejecen, se van desarmando antes de poder dañar a los tejidos sanos. Hay muchas enfermedades que dañan más o menos en función de si suceden durante el día o durante la noche, y este proceso de desarme ayuda a explicar el origen de esas diferencias clínicas”, explican los investigadores.

Development Cell
Descubren un nuevo origen de los vasos linfáticos del corazón
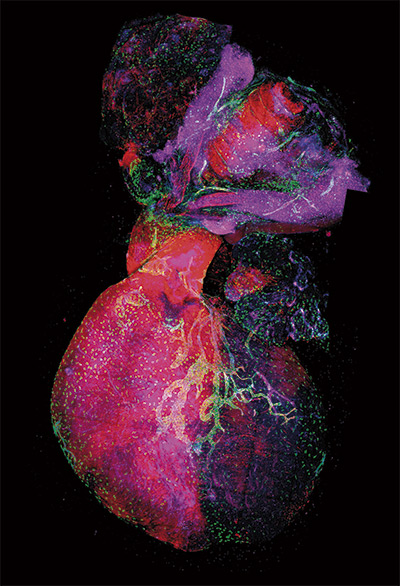
El estudio, que se publicó en Development Cell, identificó y caracterizó un nuevo nicho vasculogénico que contribuye al desarrollo linfático coronario y muestra que los vasos linfáticos cardiacos son de origen y función heterogéneos. Los resultados desvelaron que la vasculatura linfática del corazón no tiene un único origen, sino que se forma mediante la participación de células procedentes de distintos tejidos.
Este trabajo abre una nueva vía para futuros estudios sobre el mecanismo involucrado en la vasculogénesis linfática en este nuevo nicho y sobre la diversidad funcional de los vasos linfáticos cardiacos.
El estudio, liderado por el grupo del Dr. Miguel Torres desde el CNIC, investigó el origen del sistema linfático coronario durante la formación del corazón en el embrión del ratón y demuestra que, en el corazón, hay una segunda población de células linfáticas que se recluta más tarde en el desarrollo y no se origina de las venas, sino de lo que se conoce como “segundo campo cardiaco”.
Dicho segundo campo cardiaco está compuesto por células multipotentes; es decir, “capaces de producir diferentes tipos celulares del corazón, como cardiomiocitos (las células del músculo cardíaco), células de músculo liso y células endoteliales de las arterias y venas”.
Uno de los aspectos más sorprendentes de la investigación ha sido encontrar que las células linfáticas provenientes del segundo campo cardiaco se mezclan con células linfáticas de otro origen, seguramente venoso, y entre las dos poblaciones forman los vasos linfáticos de la parte ventral del corazón.
Este resultado indica que la nueva población celular descubierta no solo aporta un mayor número de células al sistema linfático, sino que lidera un proceso específico e irremplazable para la formación de la vasculatura linfática del corazón. “Este funcionamiento revela, por primera vez, la especialización de subpoblaciones endoteliales en la formación de la vasculatura coronaria y abre la puerta a un mejor entendimiento de la formación de vasos linfáticos, un proceso esencial no solo para el desarrollo embrionario del corazón sino para su respuesta a estrés o enfermedad de corazón en el corazón adulto”.
Nature Communications
El ‘airbag’ que protege a las células frente al estrés
Un equipo del CNIC identificó los mecanismos moleculares que permiten a nuestras células adaptarse, protegerse y sobrevivir frente al estrés mecánico. Los resultados, que se publicaron en Nature Communications, muestran que existen moléculas que actúan como una especie de ‘airbag’ frente al estrés mecánico. Sin este sistema de protección y adaptación, por ejemplo, el corazón, que está sometido a fuerzas mecánicas constantes, “no podría ejercer correctamente su función de bombeo sanguíneo”, explica el Dr. Miguel Ángel del Pozo , autor principal de este trabajo.
Las células humanas tienen la capacidad de percibir, adaptarse y/o responder a las fuerzas mecánicas. “En ocasiones, estas fuerzas pueden resultar excesivas, sometiendo a las células a un estrés mecánico que puede producir la rotura de la envuelta que protege a la célula, con la consiguiente muerte celular. Para evitar esta ruptura y prevenir así la muerte celular, la naturaleza ha desarrollado sensores moleculares que se ‘encienden’ en respuesta a estas fuerzas e inician procesos de adaptación y protección. El objetivo de esta respuesta es poder adaptar las células a dichas fuerzas antes de que puedan resultar lesivas para el tejido u órgano sometido a dichas fuerzas”.
La investigación identificó unos pliegues o arrugas relativamente grandes de la envuelta celular que son capaces de desplegarse o alisarse al estirar la célula, y así proveer a la célula de una envuelta extra que evitaría una rotura ante un estiramiento excesivo. “Sería análogo a un acordeón, que al estirarse se despliega, y eso hace que no se rompa al tirar de él”, explican los investigadores. Por lo tanto, estos pliegues actúan como una especie de ‘airbag’ frente al estrés mecánico.
Además, han descubierto varias moléculas que forman parte de este mecanismo que permite a la célula percibir la fuerza mecánica e iniciar los cambios bioquímicos necesarios para adaptarse al estrés mecánico.
En colaboración con el Dr. Alegre-Cebollada, del CNIC, hallaron dos moléculas con funciones opuestas; “es decir, un tipo de moléculas protegerían a la célula frente al estrés mecánico (FBP17), mientras que las otras la sensibilizarían (ABL)”, afirman los científicos.
Ambas moléculas, trabajando de forma ordenada, consiguen coordinar los cambios en la envuelta celular que protege la célula y el esqueleto celular que le confiere estructura y solidez, de tal forma que se consigue una célula más resistente al estrés mecánico.
Además, lograron alterar los niveles o la actividad de estas moléculas en células humanas. De esta forma, aseguran, “al inhibir el gen ABL, se consigue proteger a la célula frente al estrés mecánico, mientras que al inhibir el gen FBP17 se sensibiliza a la célula”.
La información que desvela este trabajo es relevante debido a que entender el proceso de protección celular frente al estrés mecánico “nos permite comprender mejor las bases moleculares de enfermedades como algunos tipos de distrofias musculares, cardiopatías o patologías pulmonares o vasculares, en las que se produce una sensibilidad al ejercicio físico o lesiones en órganos con alta actividad mecánica como el corazón, los pulmones, los músculos o los vasos sanguíneos. Esto abre la puerta en un futuro a posibles terapias en pacientes con estas patologías”, concluyen los investigadores.

Europace
La medicina personalizada llega a los pacientes con fibrilación auricular
Los pacientes con fibrilación auricular, la arritmia más común en la población, están más cerca de poder acceder a una medicina personalizada. Los resultados de una investigación liderada por el Dr. David Filgueiras, del CNIC, el Hospital Clínico San Carlos de Madrid y el CIBERCV, demuestran que es posible monitorizar y predecir la progresión individual de la fibrilación auricular gracias la información eléctrica cardiaca obtenida desde dispositivos tipo marcapasos o desfibriladores. El trabajo ha contado con financiación de la Fundación Interhospitalaria para la Investigación Cardiovascular (Fundación FIC).
El estudio, que se publicó en Europace y en el que participaron 51 hospitales españoles, indica que, gracias a la señal eléctrica cardiaca de los pacientes portadores de marcapasos o desfibriladores automáticos implantables, es posible monitorizar y predecir la progresión de la arritmia de forma personalizada y específica para cada paciente. Esto se logra mediante la tecnología actual de transmisión remota presente en dispositivos implantables, tipo marcapasos, a través de la cual se puede analizar la señal eléctrica del corazón durante los episodios de fibrilación auricular y, así, establecer tanto el estadio de la enfermedad como la velocidad de progresión de la misma.
Según el Dr. Filgueiras, “esta tecnología abre enormes posibilidades hacia una medicina personalizada para pacientes con fibrilación auricular”, porque “nos permite conocer la tasa de progresión de la arritmia de una forma paciente-específica y optimizar el momento oportuno para las actuales opciones de tratamiento”.
Para el Dr. Julián Villacastín, director del Instituto Cardiovascular del Hospital Clínico San Carlos, esta nueva aproximación en el diagnóstico de la fibrilación auricular “permitirá monitorizar la influencia de las distintas medidas terapéuticas en la progresión de la arritmia”.

EMBO Molecular Medicine
El bloqueo de una proteasa podría mejorar la terapia de la enfermedad inflamatoria intestinal
Investigadores del CNIC y del CSIC identificaron una molécula, denominada proteasa MT1-MMP, que en el futuro puede convertirse en una nueva diana terapéutica para tratar la enfermedad inflamatoria intestinal. Los resultados del estudio, liderado por laDra. Alicia G. Arroyo, publicados en EMBO Molecular Medicine, muestran que el bloqueo de esta proteasa podría mejorar el tratamiento de la enfermedad inflamatoria intestinal.
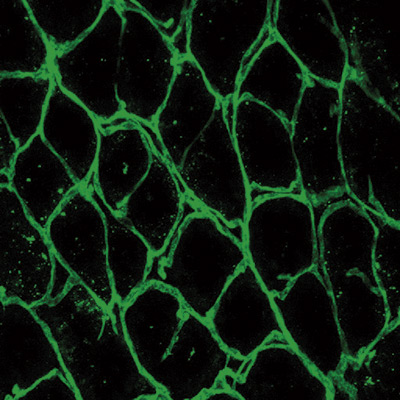
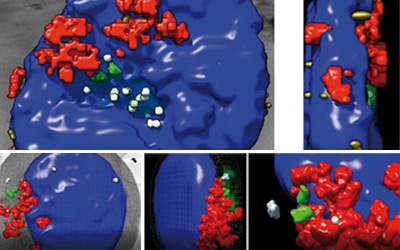
Durante la colitis, los vasos sanguíneos del intestino se duplican por mecanismos poco conocidos. Los investigadores del grupo de la Dra. Alicia G. Arroyo han implementado técnicas de microscopia y de análisis de imagen 3D para la caracterización de dichos eventos de duplicación vascular en un modelo de colitis experimental en ratones. Utilizando estas herramientas, el equipo ha demostrado que la eliminación de la proteasa MT1-MMP de las células endoteliales que forman los vasos sanguíneos disminuye la duplicación de dichos vasos en el intestino inflamado y la severidad de la colitis.
El hallazgo tiene potenciales implicaciones clínicas, destacan los autores. Por un lado, “en el estudio se ha observado que los pacientes que padecen enfermedad inflamatoria leve presentan mayores niveles de TSP1 en el suero, lo que podría ser útil como biomarcador de actividad de la enfermedad”, asegura Alicia G. Arroyo.
Además, se logró reducir la duplicación vascular en ratones con colitis mediante la administración de un anticuerpo inhibidor de la proteasa MT1-MMP o de un péptido de TSP1 bloqueante de su unión a la integrina αvβ3. Es decir, la vía MT1-MMP/TSP1/integrina αvβ3 constituye una nueva diana terapéutica, sobre todo para formas leves de la enfermedad inflamatoria intestinal.
El estudio, concluyen, “representa una nueva oportunidad para el tratamiento personalizado de pacientes con enfermedad inflamatoria intestinal, pero también de otras enfermedades en las que la duplicación capilar puede contribuir a su progresión, como el cáncer”.

















