EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
JACC: Cuanto antes mejor
Educar en hábitos saludables desde los colegios reduce la grasa abdominal

Un estudio liderado por el CNIC, la Fundación SHE y Fundación “la Caixa” demostró que educar en hábitos saludables desde los primeros años de Educación Primaria reduce la acumulación de grasa abdominal en niños y niñas. Publicado en Journal of the American College of Cardiology (JACC), es uno de los estudios más amplios y con mayor seguimiento en promoción de la salud escolar.
El estudio incluyó a 1.771 niños de 48 colegios de la Comunidad de Madrid, divididos en grupos que recibieron intervenciones educativas sobre salud integral (gestión emocional, dieta, actividad física y funcionamiento corporal) durante diferentes periodos escolares, o ninguna intervención. Las mediciones realizadas entre los 6 y 12 años revelaron que las intervenciones tempranas (en los tres primeros años) fueron más efectivas para reducir parámetros de obesidad, especialmente grasa abdominal, que las intervenciones tardías o la ausencia de estas.
El exceso de peso afecta a 1 de cada 3 niños, especialmente en los más vulnerables, y los colegios son ideales para implementar programas educativos. Este estudio respalda que intervenciones tempranas son clave para combatir la obesidad infantil. Actualmente, los investigadores están probando estrategias de reintervención para optimizar resultados y reducir la carga en docentes.
JACC Clinical Electrophysiology
La genética explicaría un gran número de casos de adultos jóvenes con marcapasos sin causa identificada

Un estudio liderado por los cardiólogos del CNIC Juan Pablo Ochoa y Pablo García-Pavía, publicado en JACC Clinical Electrophysiology, reveló que variantes genéticas raras aumentan el riesgo de trastornos de la conducción cardíaca en adultos jóvenes que requieren un marcapasos. Según el estudio, un 15% de los casos tienen una mutación genética directa, y un 30% adicional presentan alteraciones genéticas relevantes. Esto resalta la importancia de la genética en el diagnóstico y manejo de estos trastornos.
Detectar mutaciones genéticas no solo permite un diagnóstico preciso y un tratamiento precoz para prevenir complicaciones futuras, sino que también beneficia a los familiares del paciente al identificar si han heredado la mutación y están en riesgo.
El estudio analizó a 150 pacientes menores de 60 años con marcapasos de causa desconocida, comparando su perfil genético con una población de referencia. Los resultados respaldan realizar pruebas genéticas en pacientes jóvenes con trastornos de conducción cardíaca inexplicables para mejorar el tratamiento y la gestión familiar. Este es el análisis más amplio realizado sobre genética y trastornos de conducción cardíaca hasta la fecha.
Science Advances
Por qué el ejercicio físico estimula el deseo de mantenerse activo: revelan la relación molecular entre el músculo y el cerebro

Un estudio liderado por Guadalupe Sabio, actualmente en el CNIO, con participación del CNIC, descubrió un mecanismo entre músculo y cerebro que regula el deseo de hacer ejercicio. Durante el ejercicio, los músculos activan la proteína p38γ, que incrementa la secreción de interleuquina 15 (IL-15). Esta proteína estimula el córtex motor del cerebro, aumentando la motivación para ejercitarse, según datos obtenidos en modelos animales y humanos.
El estudio muestra que el entrenamiento constante potencia este efecto, incluso en condiciones de obesidad, mejorando el metabolismo y reduciendo riesgos de diabetes y acumulación de grasa hepática, sin efectos adversos significativos. En humanos, los niveles de IL-15 aumentan con el ejercicio, pero son menores en personas obesas, lo que podría convertirla en un marcador del interés por la actividad física.
El hallazgo abre puertas al diseño de programas de entrenamiento más personalizados y a posibles tratamientos, como un fármaco derivado de la IL-15, para quienes tienen mayor dificultad para mantenerse activos, como personas con obesidad. Próximos pasos incluyen investigar la relación entre ejercicio, longevidad y cáncer, y explorar cómo distintos tipos de ejercicio afectan este mecanismo.
Nature Medicine
Un equipo del CNIC descubre un nuevo factor de riesgo cardiovascular e identifica un fármaco capaz de reducir sus efectos

Un estudio del CNIC publicado en Nature Medicine confirmó que la hematopoyesis clonal, causada por mutaciones adquiridas en células madre sanguíneas, es una nueva causa de aterosclerosis, no solo una consecuencia. Utilizando datos del estudio PESA-CNIC-Santander, se demostró que personas con mutaciones asociadas a hematopoyesis clonal tienen mayor riesgo de desarrollar aterosclerosis, lo que la posiciona como un nuevo factor de riesgo cardiovascular, distinto de los tradicionales.
En paralelo, otro estudio del CNIC, publicado en European Heart Journal, propone el uso de colchicina, un medicamento antiinflamatorio económico y accesible, para mitigar los efectos de mutaciones en el gen TET2, que aceleran la aterosclerosis. En modelos animales y humanos, la colchicina redujo la inflamación y el riesgo cardiovascular en portadores de estas mutaciones.
Ambos estudios destacan el potencial de estrategias personalizadas para prevenir enfermedades cardiovasculares mediante la intervención sobre estas mutaciones.
El estudio PESA está cofinanciado por el CNIC y el Banco Santander. Estos proyectos han sido además financiados por el Ministerio de Ciencia, Innovación e Universidades (PLEC2021-008194), el CIBER de Enfermedades Cardiovasculares (CIBERCV), la Fundación “la Caixa” (LCF/PR/HR17/52150007; LCF/PR/HR22/52420011) y la Fundación “La Marató TV3” (202314-31).
Circulation
Investigadores del CNIC identifican un nuevo mecanismo de aterosclerosis precoz en un síndrome de envejecimiento prematuro

Un estudio del CNIC liderado por los doctores Vicente Andrés y Magda Hamczyk, publicado en Circulation, identifica el proceso EndMT (Transición Endotelial a Mesenquimal) como un nuevo mecanismo en la aterosclerosis prematura, y propone una nueva diana terapéutica. Este proceso implica cambios patológicos en células endoteliales, como mayor reclutamiento de células inmunes y permeabilidad al LDL, que aceleran la formación de placas ateroscleróticas. El estudio se centra en la progeria, una enfermedad genética que causa aterosclerosis precoz y muerte prematura. Se encontró que la vía TFGβ1-SMAD3, clave en el EndMT, está hiperactivada en modelos de ratón con progeria, y su inhibición con el fármaco SIS3 mejora los síntomas vasculares. Estos hallazgos no solo abren nuevas vías para tratar la progeria, sino también para enfermedades comunes como la aterosclerosis, una de las principales causas de muerte mundial. Este estudio ha sido posible gracias al apoyo del Ministerio de Ciencia, Innovación y Universidades (MICIU)/Agencia Estatal de Investigación (AEI)/10.13039/501100011033 y ERDF/EU (PID2022-141211OB-I00). El CNIC recibe apoyo del Instituto de Salud Carlos III (ISCIII), del MICIU, de la Fundación Pro-CNIC, y es un Centro de Excelencia Severo Ochoa (CEX2020-001041-S financiado por MICIU/AEI/10.13039/501100011033).
EHJ
Prevenir el daño cardiaco causado por fármacos del cáncer: objetivo del proyecto RESILIENCE
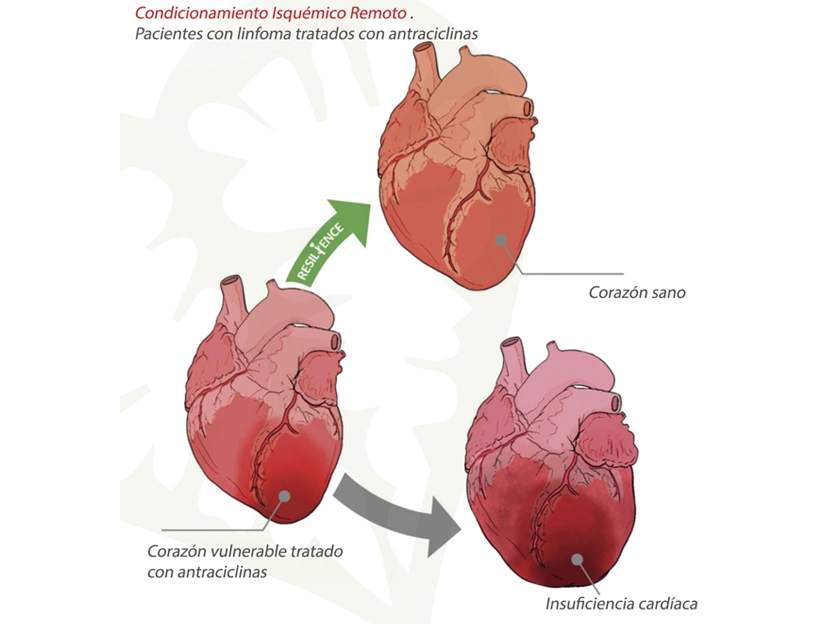
El ensayo clínico RESILIENCE investiga la efectividad y seguridad del Condicionamiento Isquémico Remoto (RIC) para prevenir la cardiotoxicidad causada por quimioterapia con antraciclinas en pacientes con linfoma. Este proyecto multinacional y doble ciego, financiado por la Unión Europea, busca reducir la incidencia de insuficiencia cardíaca crónica en supervivientes de cáncer y mejorar su calidad de vida.
El RIC consiste en aplicar interrupciones temporales del flujo sanguíneo en una extremidad para proteger el corazón de daños. El ensayo incluye 608 pacientes, de los cuales más de 220 ya han sido reclutados. Los participantes serán aleatorizados para recibir RIC semanal o un procedimiento simulado durante su quimioterapia, y serán evaluados con tecnología avanzada de resonancia magnética cardíaca (RMC) en tres fases: al inicio, después del tercer ciclo de quimioterapia y dos meses después del tratamiento.
El objetivo principal es medir los cambios en la fracción de eyección del ventrículo izquierdo mediante RMC. También se evaluará la incidencia de eventos de cardiotoxicidad, utilizando biomarcadores de daño cardíaco y nuevas técnicas de RMC para detectar etapas tempranas de afectación cardíaca. Los pacientes serán seguidos durante al menos 24 meses para evaluar resultados clínicos.
RESILIENCE es coordinado por el CNIC y cuenta con socios como la ESC y Philips Healthcare, entre otros. El proyecto busca validar métodos innovadores para proteger a pacientes con alto riesgo de cardiotoxicidad, ofreciendo nuevas perspectivas terapéuticas para un problema médico significativo.El ensayo RESILIENCE está financiado por la Comisión Europea (H2020-HEALTH, número de subvención 945118).
Cell
Investigadores del CNIC descubren un inesperado papel del sodio en la generación de energía por las mitocondrias

El grupo GENOXPHOS del CNIC y CIBERFES, liderado por el Dr. José Antonio Enríquez, ha descubierto una función esencial del sodio en la generación de energía celular. El estudio, publicado en Cell, muestra que el complejo I mitocondrial no solo transporta protones, como establecía la teoría quimiosmótica de 1961, sino que también intercambia iones de sodio, generando un gradiente crucial para la producción eficiente de ATP, la principal fuente de energía celular.
Este hallazgo explica el mecanismo molecular detrás de la neuropatía óptica hereditaria de Leber (LHON), una enfermedad neurodegenerativa causada por fallos en el ADN mitocondrial. La disfunción en el transporte sodio-protón por el complejo I provoca muerte celular, originando esta patología.
Los investigadores demostraron en modelos genéticos que el complejo I es indispensable para este transporte, mientras que otros complejos mitocondriales (como el III y IV) no afectan esta actividad. El gradiente de sodio identificado es clave para la resistencia al estrés celular y para el potencial de membrana mitocondrial, que contribuye hasta un 50% al funcionamiento energético.
Aunque existen fármacos que imitan esta función de transporte de sodio, su uso clínico es limitado debido a efectos tóxicos en otras áreas celulares. El desafío futuro es desarrollar terapias específicas para las mitocondrias. Además, el daño en el transporte sodio-protón podría estar relacionado con otras enfermedades neurodegenerativas, como el párkinson, donde el complejo I desempeña un papel patológico.
La investigación ha sido posible gracias al apoyo del Ministerio de Ciencia e Innovación (MCIN) RTI2018-099357-B-I00, y CIBERFES (CB16/10/00282), el Human Frontier Science Program (subvención RGP0016/2018) y Leducq Transatlantic Networks (17CVD04).
JACC Cardiovascular Imaging
Personas aparentemente sanas, pero con síndrome metabólico tienen una alteración de la microcirculación que riega el corazón
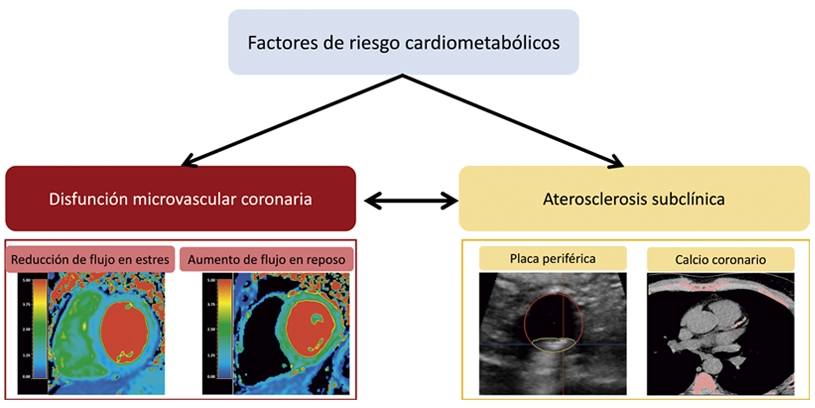
Un estudio del CNIC, publicado en JACC: Cardiovascular Imaging, analiza cómo los factores de riesgo cardiometabólicos y la aterosclerosis subclínica afectan la función microvascular coronaria en personas asintomáticas de mediana edad. La función microvascular, esencial para la regulación del flujo sanguíneo y el suministro de oxígeno al corazón, se evaluó mediante resonancia magnética en 453 participantes del estudio PESA-CNIC-Santander.
Los resultados muestran que el síndrome metabólico, la resistencia a la insulina, la diabetes y la aterosclerosis subclínica en arterias periféricas y coronarias están asociados con una función microvascular alterada. Esta disfunción podría ser un marcador temprano de riesgo cardiovascular, ayudando a predecir la progresión de la aterosclerosis y futuros eventos cardiovasculares.
El Dr. Borja Ibáñez destaca que el estudio permite detectar patrones tempranos en una población clave para la prevención de enfermedades cardiovasculares, mientras que el Dr. Valentín Fuster subraya la relevancia clínica de incluir la evaluación de la función microvascular en la práctica diaria. Durante tres años de seguimiento, los participantes con mejor función microvascular al inicio mostraron una menor progresión de la aterosclerosis.
En conclusión, este trabajo resalta que una función microvascular coronaria alterada está directamente relacionada con una mayor carga de factores de riesgo cardiometabólico y aterosclerosis sistémica, mientras que su preservación puede ser clave en la prevención de enfermedades cardiovasculares.
El estudio PESA está financiado por el Centro Nacional de Investigaciones Cardiovasculares (CNIC) y el Banco Santander. Además, la investigación ha recibido ayudas de la Comisión Europea (ERC-CoG 819775 y H2020-HEALTH 945118), el Ministerio de Ciencia e Innovación (PID2019-110369RB-I00) y la Red Madrileña de Nanomedicina en Imagen Molecular - Comunidad de Madrid (S2017/BMD-3867 RENIM-CM).
JACC
Descubren la relación entre la progresión de la aterosclerosis silente y la mortalidad global

Un estudio liderado por el Dr. Valentín Fuster en el Mount Sinai Fuster Heart Hospital y el CNIC demuestra que la carga y progresión de la aterosclerosis silente en individuos asintomáticos están asociadas de manera independiente con la mortalidad por todas las causas. Publicado en The Journal of the American College of Cardiology (JACC), el trabajo resalta la utilidad de cuantificar la aterosclerosis carotídea y coronaria mediante tecnología de imagen avanzada para predecir la mortalidad general.
El proyecto BioImage, que incluyó a 5.716 adultos asintomáticos con una edad media de 69 años, utilizó ecografía vascular y tomografía computarizada para evaluar la carga de placa carotídea y la calcificación de arterias coronarias. Durante un seguimiento de 12,4 años, el 16% de los participantes fallecieron, observándose una fuerte relación entre la carga inicial de aterosclerosis y la mortalidad. Además, la progresión de la placa carotídea proporcionó información adicional, confirmando su valor pronóstico independiente.
El Dr. Borja Ibáñez destaca que la ecografía vascular, una técnica no invasiva y económica, puede ayudar a estratificar el riesgo y personalizar estrategias de prevención cardiovascular. Este estudio refuerza la importancia de detectar la aterosclerosis en su fase asintomática, lo que abre una ventana para intervenciones tempranas y más efectivas.
EUROPACE
Una nueva estrategia de procesado de imagen de resonancia magnética cardíaca identifica zonas clave relacionadas con taquicardias complejas

Un trabajo multicéntrico liderado por el Hospital Clínico San Carlos y el CNIC describe una nueva metodología basada en imágenes de resonancia magnética cardíaca para guiar procedimientos de ablación en pacientes con taquicardias ventriculares postinfarto. La estrategia permite identificar de manera precisa las zonas responsables de estas arritmias en regiones del corazón afectadas por cicatrices, eliminando el sesgo asociado a la selección manual de parámetros de imagen y ofreciendo una planificación más segura y eficiente.
El estudio, publicado en Europace, incluyó modelos experimentales y validaciones clínicas en pacientes entre 2013 y 2022. Destaca la capacidad de esta técnica para evitar el uso de cartografía clásica invasiva, que conlleva riesgos significativos en pacientes graves. La nueva metodología simplifica la planificación preoperatoria y estandariza el procesamiento de imágenes, reduciendo la variabilidad y mejorando la precisión.
Los resultados indican que la estrategia propuesta podría aumentar las tasas de éxito en la ablación de taquicardias ventriculares postinfarto y facilitar su implementación en sistemas comerciales actuales. Este avance es especialmente valioso en pacientes con episodios graves y mal tolerados, permitiendo una planificación personalizada y reduciendo complicaciones y tiempo del procedimiento.
La investigación ha contado con el apoyo del Ministerio de Ciencia e Innovación (MCIN) y la Fundación Pro CNIC, siendo el CNIC un centro de Excelencia Severo Ochoa (CEX2020-001041-S). También fue apoyada por fondos del MCIN (PID2019-109329RB-I00) y la Asociación de Ritmo Cardiaco de la Sociedad Española de Cardiología. Además, el estudio contó con el apoyo de la Fundación Interhospitalaria para la Investigación Cardiovascular (FIC) y la Fundación Eugenio Rodríguez Pascual.
JCI
Desvelan un mecanismo clave en el desarrollo de la enfermedad cardiovascular en el síndrome de Progeria de Hutchinson-Gilford

Un equipo de investigación del CNIC, CIB-CSIC, e ICMM-CSIC ha realizado un avance significativo en la comprensión de los mecanismos subyacentes a la aterosclerosis en el Síndrome de Progeria de Hutchinson-Gilford (HGPS), una rara enfermedad genética que acelera el envejecimiento. El estudio, publicado en The Journal of Clinical Investigation, ha identificado la activación de la vía YAP/TAZ en las células endoteliales como un factor clave en el desarrollo de aterosclerosis en pacientes con HGPS.
El HGPS es causado por una mutación en el gen LMNA, lo que produce la proteína tóxica progerina y acelera el envejecimiento celular. Los pacientes desarrollan aterosclerosis grave en su adolescencia, lo que lleva a complicaciones cardiovasculares fatales. El equipo utilizó secuenciación de ARN de célula única para analizar los cambios en la expresión génica en las células endoteliales de modelos de ratón con HGPS, descubriendo que la vía YAP/TAZ se activaba anormalmente en la aorta, promoviendo inflamación y acumulación de células inmunitarias, acelerando así la aterosclerosis.
El equipo también exploró una posible estrategia terapéutica mediante la inhibición de esta vía usando verteporfina, un fármaco aprobado para otras condiciones. Los resultados mostraron que la verteporfina redujo significativamente el desarrollo de aterosclerosis en los ratones con HGPS. A pesar de estos resultados prometedores, los investigadores destacan que se necesita más trabajo para garantizar que la inhibición de YAP/TAZ sea segura, debido a que esta vía también juega un papel en procesos biológicos normales, como la reparación de tejidos.
Este hallazgo no solo tiene implicaciones para el tratamiento del HGPS, sino que también podría ofrecer nuevas perspectivas sobre el envejecimiento vascular y las enfermedades cardiovasculares en la población general, ya que muchos de los procesos identificados en la progeria son comunes en el envejecimiento normal. El estudio sugiere que comprender mejor las vías moleculares involucradas en el envejecimiento podría conducir al desarrollo de terapias para promover un envejecimiento saludable y mejorar la calidad de vida.
Este estudio ha sido financiado por subvenciones del Ministerio de Ciencia, Innovación y Universidades (MICIU) y la Agencia Estatal de Investigación (AEI) (MICIU/AEI/10.13039/501100011033); fondos FEDER/UE y “NextGenerationEU”/PRTR (PID2022-141211OB-I00, PID2022-137111OA-I00, RYC2021-033805-I), y Comunidad de Madrid con cofinanciación de los fondos EIE/FSE (2017-T1/BMD-5247, 2021-5A/BMD-20944).
Nature Communications
Descubren un mecanismo clave en el desarrollo y funcionamiento del sistema de conducción cardíaco
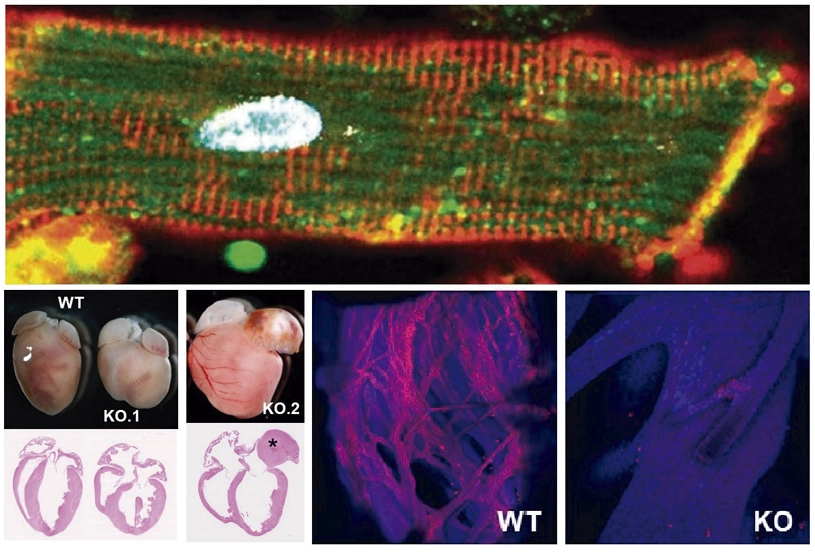
Un estudio publicado en Nature Communications por un equipo de investigación del Instituto de Investigación de Enfermedades Raras del Instituto de Salud Carlos III (ISCIII), CIBER, CNIC, la Universitat Pompeu Fabra (UPF) y el Centro de Biología Molecular Severo Ochoa (CBM, CSIC-UAM) ha identificado la proteína Dhx36 como un regulador esencial para el desarrollo y funcionamiento del corazón, particularmente en el sistema de conducción cardíaco.
Este avance, liderado por los científicos Pablo Gómez del Arco (ISCIII), Pura Muñoz-Cánoves (UPF y Altos Labs), y Juan Miguel Redondo (CBM, CSIC-UAM), ha mostrado que Dhx36 modula las redes de genes que controlan la diferenciación de los cardiomiocitos, mediante la resolución de estructuras G-cuádruplex en los promotores de genes clave del sistema de conducción cardíaco. Esta función es crucial para la formación de células especializadas que forman el sistema de conducción que transmite y controla los impulsos eléctricos del corazón.
El estudio también ha demostrado que la ausencia de Dhx36 en los cardiomiocitos de ratones durante el desarrollo embrionario y en la edad adulta provoca graves problemas cardíacos, incluyendo miocardiopatía dilatada y bloqueos en la transmisión del impulso eléctrico entre las cavidades del corazón, en particular entre las aurículas y los ventrículos. Estos hallazgos sugieren que Dhx36 es fundamental para mantener la salud cardíaca, especialmente después del nacimiento, y que defectos en esta proteína podrían estar relacionados con enfermedades cardíacas que afectan la actividad eléctrica del corazón y causan miocardiopatía dilatada.
El estudio también ha identificado los genes y vías de señalización involucrados en la diferenciación celular cardíaca y en el desarrollo del sistema de fibras especializadas del sistema de Purkinje, fundamental para la sincronización de la contracción ventricular. Los resultados sugieren que la regulación transcripcional juega un papel crucial en la función cardíaca y abre nuevas perspectivas para el desarrollo de terapias para tratar trastornos en el sistema de conducción cardíaco, como aquellos asociados con la insuficiencia cardíaca.
Science Advances
Un estudio propone un nuevo enfoque sobre cómo las células responden a las señales mecánicas de su entorno

Un estudio realizado en el CNIC, dirigido por el Dr. Jorge Alegre-Cebollada, ha revelado el papel fundamental de la viscoelasticidad de los tejidos, una propiedad aún poco explorada, en el funcionamiento celular. La matriz extracelular (ECM), que es una red de proteínas que sostiene y conecta las células, influye en procesos como la migración, proliferación y diferenciación celular a través de sus propiedades mecánicas, como la rigidez y la viscoelasticidad.
Hasta ahora, los estudios sobre las propiedades mecánicas de la ECM se habían centrado principalmente en la rigidez, especialmente en el contexto de enfermedades como el infarto de miocardio y algunos tipos de cáncer, pero la respuesta de las células a la viscoelasticidad no se había comprendido completamente, especialmente en tejidos más rígidos. El estudio, publicado en la revista Science Advances, demuestra por primera vez cómo la viscoelasticidad de los tejidos juega un papel crucial en el proceso conocido como homeostasis celular, que es la capacidad de las células de mantener un equilibrio interno adecuado para su funcionamiento.
Según la Dra. Carla Huerta-López, quien lideró el estudio, la viscoelasticidad regula el tiempo que las células necesitan para responder a estímulos mecánicos. Usando el ejemplo de un colchón viscoelástico que tarda en recuperar su forma tras un movimiento, Huerta-López compara este proceso con cómo las células necesitan tiempo para recuperarse de alteraciones mecánicas, como un apretón de manos o un golpe.
El equipo de investigación desarrolló biomateriales basados en proteínas que imitan las propiedades mecánicas de la ECM para estudiar cómo las células responden a la viscoelasticidad. Utilizando estos biomateriales y un modelo computacional, los investigadores descubrieron un mecanismo en el cual la viscoelasticidad de los tejidos contrarresta la respuesta celular a la rigidez de una manera inesperada. Este hallazgo contradice modelos previos y proporciona nuevas explicaciones sobre cómo las células reaccionan ante las propiedades mecánicas de su entorno, lo cual podría tener implicaciones en la mejora de tejidos artificiales y en el tratamiento de enfermedades asociadas con cambios en la viscoelasticidad de los tejidos, como ciertos tipos de cáncer y enfermedades cardiovasculares.
El estudio ha sido posible gracias a la financiación recibida desde el Ministerio de Ciencia, Innovación y Universidades, el Consejo Europeo de Investigación (ERC), y la Comunidad de Madrid a través del consorcio interdisciplinar Tec4Bio-CM. Es de destacar que cuatro de los investigadores principales de Tec4Bio-CM han participado directamente en el desarrollo de este trabajo desde el CNIC, el ICMM-CSIC y la Universidad Politécnica de Madrid.
Nature Communications
Descubren un mecanismo clave en las células grasas para proteger al organismo del exceso energético

Un equipo del CNIC, liderado por el Profesor Miguel Ángel del Pozo Barriuso, identificó un mecanismo clave en las células grasas (adipocitos) que les permite expandirse de manera segura para almacenar energía, evitando daños en los tejidos. El estudio, publicado en Nature Communications, podría ofrecer nuevas terapias para enfermedades metabólicas como obesidad y lipodistrofia.
El proceso involucra las caveolas, invaginaciones en la membrana celular que protegen a los adipocitos al permitirles expandirse sin romperse. Cuando los adipocitos acumulan grasa, las caveolas se aplanan, liberando membrana para acomodar el exceso. Además, estas estructuras coordinan la actividad metabólica celular. Sin embargo, cuando las caveolas no funcionan correctamente, los adipocitos se vuelven rígidos y vulnerables, lo que puede provocar inflamación y alteraciones metabólicas.
El estudio también resalta la proteína Caveolina-1 (Cav1), esencial para el funcionamiento adecuado de las caveolas. Si Cav1 no se fosforila correctamente, los adipocitos no pueden expandirse adecuadamente, lo que puede llevar a la lipodistrofia y sus complicaciones metabólicas y cardiovasculares. Este descubrimiento proporciona una mejor comprensión de cómo el exceso energético afecta al organismo, especialmente en el contexto de enfermedades metabólicas.
Este estudio ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades (MICIU)/Agencia Estatal de Investigación (AEI)/Fondo Europeo de Desarrollo Regional (FEDER) “Una manera de hacer Europa” (SAF2017-83130-R, IGP-SO grant MINSEV1512-07-2016, BFU2016-81912-REDC y SAF2020 (PID2020-118658RB-I00)), y por la Fundación “la Caixa” (AtheroConvergence, HR20-00075), así como por la Comunidad Autónoma de Madrid (Tec4Bio-CM, S2018/...), la Fundació La Marató de TV3 (201936-30-31), y la Asociación Española Contra el Cáncer (PROYE20089DELP).
Nature Methods
CNIC presenta iFlpMosaics: una innovadora herramienta genética para el estudio de la función génica

Un equipo del CNIC, liderado por el Dr. Rui Benedito, ha desarrollado iFlpMosaics, un conjunto innovador de herramientas genéticas y líneas de ratones que mejora el estudio de la función génica y sus implicaciones en la salud y enfermedad. El estudio, publicado en Nature Methods, presenta un enfoque pionero que supera las limitaciones de los métodos actuales para generar mosaicos genéticos, permitiendo investigar con mayor precisión los efectos de mutaciones somáticas en biología celular y enfermedades.
La herramienta iFlpMosaics permite inducir y rastrear células normales y mutantes en el mismo tejido animal, lo que ofrece una comprensión más profunda de la función génica en procesos como regeneración y enfermedad. A diferencia de los métodos tradicionales, que comparan células de diferentes animales, iFlpMosaics elimina la disparidad de factores epigenéticos y microambientes tisulares, ofreciendo un análisis más fiable.
Este avance mejora la comprensión de cómo las mutaciones genéticas afectan el desarrollo de órganos y enfermedades, incluyendo cáncer y malformaciones vasculares. Además, proporciona una plataforma más eficiente para inducir mosaicos genéticos con alta precisión, facilitando el estudio de interacciones celulares dentro de sus microambientes.
Según el Dr. Benedito, iFlpMosaics representa un gran paso en la investigación biomédica, permitiendo un estudio más detallado de la función génica tanto en condiciones normales como en contextos patológicos.
Este estudio ha sido financiado por el European Research Council (ERC) a través del Starting Grant AngioGenesHD (638028) y el Consolidator Grant AngioUnrestUHD (101001814), el Ministerio de Ciencia e Innovación (SAF2017-89299-P y PID2020-120252RB-I00), y la Fundación ”la Caixa” (HR19-00120 y HR22-00316 AngioHeart).













