EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
JAMA CARDIOLOGY
Desvelan las mutaciones que originan una de las malformaciones congénita del corazón más frecuentes

La válvula aórtica bicúspide es la malformación congénita más común en los seres humanos, afectando alrededor del 1 al 2% de la población. Consiste en la presencia de dos valvas asimétricas en lugar de tres simétricas. A menudo, la malformación causa estenosis valvular, endocarditis y está asociada con una calcificación temprana de la válvula aórtica. Actualmente, el único tratamiento disponible es la sustitución quirúrgica de la válvula.
Pero los resultados de un nuevo trabajo que ha sido co-liderado por el grupo de investigación del Dr. José Luis de la Pompa del CNIC podrían cambiar este escenario.
Este innovador estudio multicéntrico, publicado en JAMA Cardiology, revela que mutaciones nuevas y otras previamente descritas por este mismo grupo en el gen MINDBOMB1 (MIB1) en la revista Nature Medicine son la causa de la válvula aórtica bicúspide.
Esta información, señala el Dr. De la Pompa, se espera que tenga un importante impacto en la sociedad, ayudando en el futuro en el diseño de posibles terapias farmacológicas y alternativas que conduzcan a la reducción de la sustitución quirúrgica de la válvula, el único tratamiento actual para la válvula aórtica bicúspide.
Para el investigador, “esto es especialmente relevante ya que la válvula aórtica es la malformación congénita más común. Además, podría contribuir a reducir los altos costes que el tratamiento de esta enfermedad supone para el Sistema Nacional de Salud”.
La investigación combina la secuenciación del genoma y de genes candidatos en una cohorte familiar, el estudio de asociación de variantes raras en cohortes adicionales y también el estudio de asociación de variantes comunes en una tercera cohorte grande, explica Idit Tessler, del Hospital Sheba (Israel) y co-líder del estudio. Además, el análisis de mutaciones se realizó en pacientes de diferentes poblaciones, lo que proporciona una mayor solidez al estudio.
Posteriormente, se validaron los resultados en modelos de ratones in vivo con el objetivo de analizar los mecanismos específicos por los cuales el gen MIB1 es tan importante para el desarrollo correcto del corazón. Para ello, Rebeca Piñeiro-Sabarís del equipo del CNIC y co-primera autora en el estudio, introdujo dichas mutaciones en el genoma del ratón utilizando la técnica de edición genética conocida como “CRISPR-Cas9”.
Tras introducir estas mutaciones en MIB1 en un fondo genético parcialmente deficiente para NOTCH (fondo genético “sensitizado”), los investigadores observaron que los ratones doble heterocigotos desarrollaban la válvula aórtica bicúspide con una frecuencia elevada, a diferencia de lo observado en los pacientes que presentan la malformación con un único alelo mutante para MIB1 (heterocigotos). Además, estos ratones doblemente mutantes también mostraban defectos en el septo interventricular. Este trabajo forma parte de la tesis doctoral de Rebeca Piñeiro-Sabarís.
Los investigadores concluyen que la asociación genética identificada en este estudio entre el gen MIB1 y la válvula aórtica bicúspide (BAV) subraya el importante papel que tiene la vía de señalización NOTCH en la fisiopatología de la BAV y su potencial como diana tanto para el diseño de nuevas líneas diagnósticas y terapéuticas.
La investigación ha recibido financiación del Ministerio de Ciencia e Innovación (MICIN).
JAMA CARDIOLOGY
Promoción de la salud cardiovascular en adolescentes en la escuela: un ensayo clínico aleatorizado por grupos
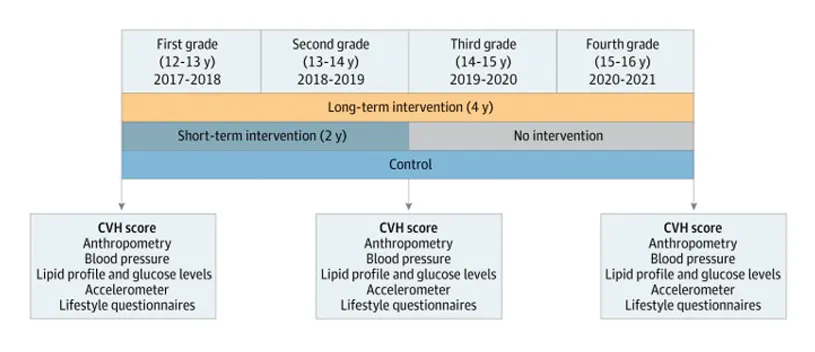
La revista JAMA Cardiology publicó los resultados finales de un proyecto que se ha llevado a cabo desde la Fundación SHE, el CNIC y la Universitat de Barcelona en el que han participado 1.326 adolescentes de 24 centros públicos de enseñanza secundaria de Madrid y Barcelona.
Los datos han mostrado un impacto beneficioso en los adolescentes, que ha dependido en gran parte de la intensidad del contenido educativo. Desafortunadamente, dicho impacto no se mantuvo en el tiempo.
El Programa SI! (Salud Integral) para la promoción de la salud cardiovascular en el entorno escolar diseñado por la Fundación SHE, con el apoyo de la Fundación “la Caixa”, y dirigido por el Dr. Valentín Fuster, director del CNIC, abarca las etapas educativas de Educación Infantil, Primaria y Secundaria, y se dirige a niños y niñas de los 3 a los 16 años. Desde 2009, ha sido evaluado mediante ensayos aleatorizados en tres países con diferentes contextos socioeconómicos y en diversas edades: Colombia, España y EE.UU. Dichos estudios han contado con aproximadamente 7.000 niños y niñas.
Trabaja cuatro componentes básicos e interrelacionados entre sí: alimentación, actividad física, cuerpo y corazón, y gestión emocional. Además, cuenta con contenidos y estrategias adaptadas a cada franja de edad abarcando a toda la comunidad educativa (aula, profesorado, ambiente escolar y familia).
El trabajo publicado ahora se ha basado en una intervención escolar de promoción de la salud dirigida a más de 1.000 adolescentes de 12 a 16 años. Su objetivo principal fue evaluar el impacto de dos versiones de la intervención educativa del Programa SI! de Secundaria, de diferente duración e intensidad, sobre el estilo de vida y los parámetros de salud de los adolescentes.
Los 24 institutos participantes fueron asignados aleatoriamente al grupo de intervención -seguimiento del programa educativo durante los dos primeros cursos de Secundaria o durante los 4 cursos de esta etapa educativa o al grupo de control que siguió con su plan de estudios habitual.
Para evaluar la salud cardiovascular de los adolescentes antes, durante y después de la intervención, se utilizó la métrica de salud cardiovascular que recomienda la Asociación Americana del Corazón, que incluye: hábitos y parámetros como el peso, la alimentación, la actividad física, el consumo de tabaco, la tensión arterial, el colesterol y la glucosa en sangre.
El Programa SI! de Secundaria mostró una mejora significativa en la salud cardiovascular de los adolescentes que llevaron a cabo la versión extendida de la intervención, cuando se evaluó a mitad del programa. Sin embargo, la intervención de 2 años, más corta pero más intensa, no consiguió efectos significativos.
La segunda parte de la intervención se vio afectada por la pandemia de covid-19, por lo que los resultados relativos a la evaluación final han de ser tomados con cautela.
Aunque afortunadamente las iniciativas de promoción de la salud en el entorno escolar han aumentado significativamente en los últimos años, son muy pocas las que se focalizan en la salud cardiovascular de una manera global, por lo que es necesario seguir optimizando las intervenciones escolares para definir las estrategias más efectivas.
Este estudio ha contado con el apoyo de la Fundación SHE-Fundación la Caixa, el Instituto de Salud Carlos III (ISCIIII) y la Fundació La Marató de TV3.
NATURE COMMUNICATIONS
Una nueva técnica mejora la precisión diagnóstica y la terapia personalizada de una arritmia común

Un trabajo multidisciplinar dirigido por el CNIC ha permitido el desarrollo de un nuevo abordaje para valorar los cambios estructurales y electrofisiológicos que se producen en el corazón, denominados remodelado auricular, de pacientes con un tipo de arritmia muy frecuente, la fibrilación auricular. Esta nueva aproximación diagnóstica se basa en la evaluación de forma simultánea de la actividad eléctrica y mecánica (contráctil) de las aurículas durante fibrilación auricular. El estudio se publicó en la revista Nature Communications.
La fibrilación auricular es un ritmo cardíaco irregular y a menudo muy rápido que puede provocar coágulos de sangre en el corazón y que aumenta el riesgo de accidente cerebrovascular, insuficiencia cardíaca y otras complicaciones relacionadas con el corazón.
Hoy en día, la clasificación de los pacientes con fibrilación auricular se basa fundamentalmente en criterios temporales en función del tiempo que el paciente ha estado con la arritmia. Sin embargo, explica David Filgueiras, jefe del grupo Desarrollo Avanzado sobre Mecanismos y Terapias de las Arritmias del CNIC y cardiólogo del Instituto de Investigación Sanitaria del Hospital Clínico San Carlos (IdISSC), “esta clasificación temporal no permite determinar el grado de remodelado subyacente de un paciente en concreto, lo cual tiene especial importancia en los primeros meses de evolución de la fibrilación auricular cuando el grado de avance de los procesos patológicos subyacentes puede seguir distintas velocidades de progresión”.
Para Filgueiras, “la relevancia de este nuevo abordaje diagnóstico se pone de manifiesto en su capacidad para hacer una evaluación personalizada del grado de avance del remodelado auricular en un paciente en concreto, más allá de la clasificación clínica basada en un criterio temporal”.
Daniel Enríquez Vázquez, del Complejo Hospitalario Universitario de A Coruña y miembro del CIBERCV, junto con los otros dos primeros firmantes del trabajo, Jorge G. Quintanilla y Alba García Escolano, del CNIC, destacan que “a nivel clínico, los resultados del trabajo indican que la identificación de disociación electromecánica en pacientes con fibrilación auricular nos informa de un mayor avance de la enfermedad y la necesidad de tomar decisiones más rápidas para devolver de forma eficaz y duradera el ritmo cardíaco normal a estos pacientes”.
El equipo dirigido por Filgueiras, en colaboración con investigadores nacionales e internacionales del Hospital Clínico San Carlos, Hospital Universitario Central de Asturias, Hospital de la Santa Creu i Sant Pau, el Complejo Hospitalario Universitario de A Coruña, Universidad Complutense de Madrid, Universidad Politécnica de Madrid, Universidad Autónoma de Barcelona, Universidad de Connecticut (EEUU) y CIBERCV, ha trabajado durante los últimos 10 años para que puedan integrarse la información eléctrica y mecánica, y permitir así una caracterización personalizada del estadio de los cambios patológicos asociados a la progresión de la fibrilación auricular.
En una primera fase, clínicos, ingenieros y físicos idearon la estrategia más adecuada para integrar ambos tipos de información. La solución se obtuvo integrando la señal de imagen Doppler tisular de las aurículas -una prueba no invasiva que permite obtener señales relacionadas con el desplazamiento del tejido- para evaluar la actividad mecánica, con la señal del electrocardiograma de superficie, para evaluar la actividad eléctrica.
Ambos tipos de información se obtienen de forma no invasiva y pueden registrarse durante la realización de un estudio de ecocardiografía transtorácica - prueba que estudia la forma y función del corazón y parte de sus estructuras internas-, lo cual facilita su implementación en el ámbito clínico.
Una segunda fase con investigadores del ámbito de la biología, biotecnología, bioquímica e ingeniería biomédica, junto con la unidad de proteómica de CNIC y cardiólogos clínicos, permitió la realización de estudios experimentales para correlacionar el tipo de información obtenida con este nuevo abordaje y los cambios patológicos subyacentes en el tejido auricular a medida que la fibrilación auricular progresa en el tiempo.
Asimismo, se desarrollaron nuevas técnicas de cartografía avanzada y simulaciones computacionales para entender los mecanismos subyacentes al proceso de remodelado eléctrico y mecánico durante la progresión temporal de la fibrilación auricular. Finalmente, el trabajo incluyó un estudio prospectivo multicéntrico en 83 pacientes reclutados durante estadios precoces de evolución de la fibrilación auricular, con el objetivo de determinar el valor pronóstico de la evaluación eléctrica y mecánica de las aurículas de los pacientes con este tipo de arritmia.
Los hallazgos a nivel experimental y clínico permitieron observar que en fases precoces de evolución de la fibrilación auricular se desarrolla un desequilibrio entre las activaciones eléctricas y las activaciones mecánicas (contráctiles) de las aurículas del corazón, de tal forma que ambos parámetros se disocian y la frecuencia de activación contráctil no es capaz de seguir la actividad eléctrica, en lo que los investigadores definen como disociación electromecánica auricular.
El desarrollo de esta disociación es un proceso con evolución temporal específica para cada persona, aunque en la gran mayoría de casos se produce en los 2-3 primeros meses tras el inicio de episodios de fibrilación auricular que no se han interrumpido.
Además, la identificación de la disociación electromecánica auricular ocurre antes de que otros parámetros de remodelado se hayan puesto de manifiesto y, por lo tanto, pasen desapercibidos durante una evaluación clínica rutinaria o con herramientas convencionales. Así, subraya Filgueiras, “el uso de esta nueva aproximación diagnóstica permite una caracterización precoz del grado de remodelado subyacente de los pacientes con fibrilación auricular”.
“El estudio demuestra que es posible integrar la información eléctrica y mecánica de las aurículas de los pacientes en fibrilación auricular y así obtener información pronóstica personalizada con respecto a la evolución clínica de la arritmia”, afirma Filgueiras.
La fibrilación auricular afecta en España ya a más de 700.000 personas y en Europa supera la cifra de 10 millones de pacientes diagnosticados.
La investigación ha contado con el apoyo del programa H2020 de la Unión Europea (Grant Agreement#965286), el Ministerio de Ciencia e Innovación (PID2019-109329RB-I00 y PGC2018-097019-B-I00), el Instituto de Salud Carlos III (Fondo Europeo de Investigación Sanitaria PRB3 (PT17/0019/0003- ISCIII-SGEFI / ERDF, ProteoRed), la Fundación Interhospitalaria para la Investigación Cardiovascular, el CIBERCV, la Fundación Salud 2000 y La Fundación La Caixa (código proyecto HR17-00247).
THE LANCET HEALTHY LONGEVITY
Cuanto antes empecemos a controlar los factores de riesgo cardiovascular, mejor para nuestro cerebro
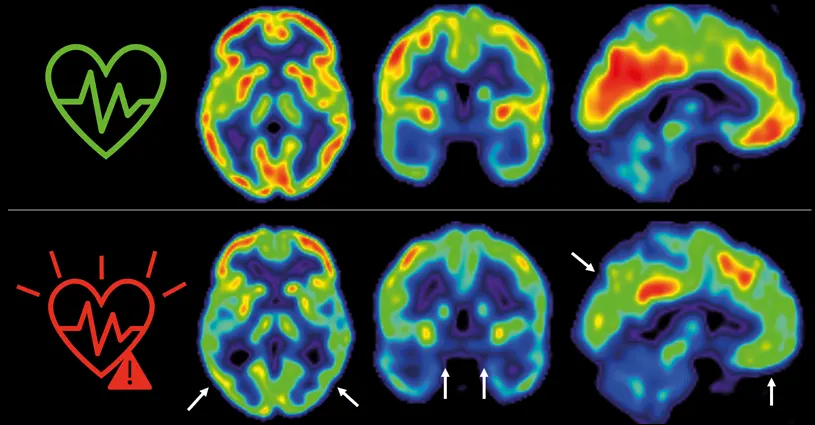
Las enfermedades cardiovasculares y la demencia coexisten en etapas avanzadas en muchas ocasiones; sin embargo, hay pocos estudios longitudinales en personas de mediana edad, 50 años, que hayan evaluado la interacción entre la aterosclerosis y sus factores de riesgo sobre la salud del cerebro. Ahora, una investigación realizada en CNIC arroja nuevos datos sobre esta relación y confirma la relevancia de controlar los factores de riesgo cardiovascular tradicionales, como hipertensión, colesterol, diabetes, tabaquismo o sedentarismo, no solo para cuidar la salud cardiovascular, sino también para prevenir enfermedades como el alzhéimer.
Publicado en The Lancet Healthy Longevity, la investigación del CNIC muestra que la aterosclerosis -el acúmulo de placas de grasa en las arterias- y sus factores de riesgo asociados, además de ser las principales causas de enfermedad cardiovascular, están también implicados en alteraciones cerebrales típicas de la enfermedad de Alzheimer, la causa más común de demencia.
La información es muy relevante porque, asegura el Dr. Valentín Fuster, Director General del CNIC y uno de los autores principales del estudio, abre la posibilidad de intervenir sobre un trastorno modificable, como las enfermedades cardiovasculares, para prevenir el desarrollo de las demencias, para las que no existe tratamiento para muchos pacientes. “Cuanto antes empecemos a controlar los factores de riesgo cardiovascular, mejor será para nuestro cerebro”, indica el Dr. Fuster.
Asimismo, subraya el director del CNIC, “a pesar de que todos sabemos la importancia de cuidarse y controlar los factores de riesgo cardiovascular para evitar un infarto, el hecho de que están relacionados con un deterioro de la salud cerebral puede hacer que haya una mayor conciencia de la necesidad de adquirir hábitos saludables en las fases más jóvenes de la vida”.
En 2021, los investigadores del CNIC descubrieron que la presencia de factores de riesgo cardiovascular y de aterosclerosis subclínica -antes de que aparezcan los síntomas- en las arterias carótidas, que son las que suministran sangre al cerebro, en individuos de 50 años aparentemente sanos que participan en el estudio PESA-CNIC-Santander, estaba asociada a un menor metabolismo de glucosa cerebral. El metabolismo de la glucosa cerebral está considerado un indicador de salud cerebral.
El PESA-CNIC-Santander es un estudio prospectivo que incluye a más de 4.000 participantes asintomáticos de mediana edad en los cuales se está evaluando exhaustivamente la presencia y desarrollo de aterosclerosis subclínica desde el año 2010.
El equipo del Dr. Valentín Fuster, liderado por los Drs. Marta Cortés Canteli y Juan Domingo Gispert, han seguido a estos individuos a lo largo de 5 años y han encontrado que aquellos que mantienen un riesgo cardiovascular elevado durante todo este tiempo sufren una disminución aún mayor del metabolismo cerebral medido a través de técnicas de imagen como tomografía por emisión de positrones (PET).
“Hemos detectado un declive metabólico cerebral tres veces mayor que el de personas que se mantienen en bajo riesgo cardiovascular”, señala Catarina Tristão-Pereira, primera firmante del artículo y becaria INPhINIT de la Fundación ”la Caixa.
La glucosa es la principal fuente de energía de las neuronas y otras células cerebrales. “Si el consumo de glucosa cerebral disminuye durante varios años puede limitar la capacidad del cerebro de lidiar en un futuro con enfermedades neurodegenerativas o cerebrovasculares”, asegura el Dr. Gispert, experto en Neuroimagen del CNIC y del Barcelonaßeta Research Center.
De hecho, en colaboración con los doctores Henrik Zetterberg y Kaj Blennow de la Universidad de Gotemburgo (Suecia), expertos mundiales en la determinación de nuevos biomarcadores en sangre, los investigadores de CNIC descubrieron que este declive metabólico se debía en parte a que ya existía daño neuronal en estos individuos. “Este dato es particularmente relevante ya que la muerte de las neuronas es un proceso irreversible”, remarca la Dra. Cortés Canteli, neurocientífica del CNIC e investigadora Miguel Servet del Instituto de Investigación Sanitaria Fundación Jiménez Díaz.
Además, el equipo del CNIC descubrió que la progresión de la aterosclerosis subclínica en las carótidas durante estos 5 años se relacionaba con una disminución del metabolismo en regiones cerebrales vulnerables a la enfermedad de Alzheimer, de manera aditiva al efecto de los propios factores de riesgo cardiovascular.
Los investigadores concluyen que, a la luz de estos resultados, “el cribado de la carótida tiene un gran potencial para identificar a las personas vulnerables a sufrir alteraciones cerebrales y deterioro cognitivo en el futuro”. Así, escriben, “este trabajo podría tener importantes implicaciones para la práctica clínica ya que apoya la implementación de estrategias de prevención cardiovascular primaria en etapas tempranas de la vida como enfoque valioso para una longevidad cerebral saludable”.
“Aunque aún no conocemos el impacto que esta disminución en el metabolismo cerebral puede tener sobre la función cognitiva, el haber detectado ya daño neuronal sí que nos indica que cuanto antes empecemos a controlar los factores de riesgo cardiovascular, mejor será para nuestro cerebro”, concluye la Dra. Cortés Canteli.
El estudio PESA está cofinanciado a partes iguales por CNIC y Banco Santander. Además, recibe financiación del Instituto de Salud Carlos III (ISCIII, PI15/02019 & PI20/00819), Fondo Europeo de Desarrollo Regional (ERDF - A Way to Build Europe) y el Fondo Social Europeo (ESF - Investing in Your Future).
Asimismo, para este estudio en particular también ha recibido financiación de la Fundación BrightFocus y una Beca Leonardo a Investigadores y Creadores Culturales de la Fundación BBVA. CNIC cuenta con el apoyo del ISCIII, el Ministerio de Ciencia e Investigación (MCIN) y Fundación Pro-CNIC. En el estudio han participado investigadores del CIBER de Enfermedades Cardiovasculares (CiberCV), del CIBER de Fragilidad y Envejecimiento Saludable (CiberFES) y el CIBER de Bioingeniería, Biomateriales y Nanomedicina (Ciber-BBN).
DIABETES CARE
Factores como obesidad, hipertensión o dislipemia inducen una pérdida progresiva de energía en el corazón
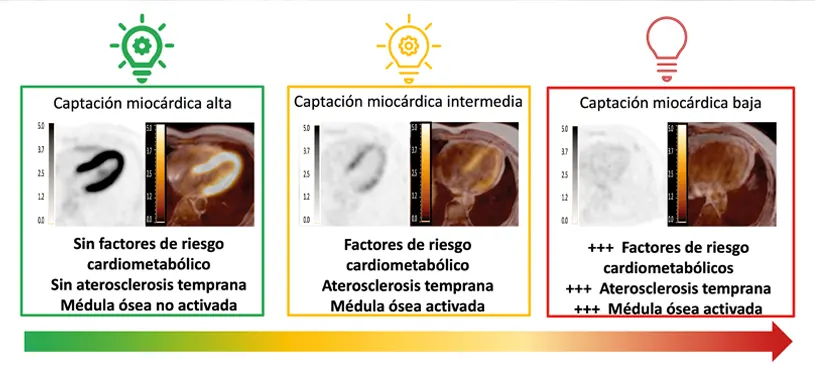
La obesidad, hipertensión, la dislipemia (concentración elevada de colesterol y/o triglicéridos en sangre), factores de riesgo cardiovasculares, alteran la producción de energía de nuestro corazón. Esto se debe a la incapacidad del corazón para captar los sustratos que actúan como combustible necesario para producir energía. Dichos sustratos son principalmente grasas y glucosa. Esta alteración en la obtención del combustible necesario para la producción de energía en el corazón podría ser el origen de enfermedades, como la insuficiencia cardiaca, que aparecen muchos años después de este fenómeno.
Lo desvela un estudio publicado en Diabetes Care, la revista de la asociación americana de Diabetes y referencia mundial en campo, realizado por un equipo del CNIC, liderado por los cardiólogos Valentín Fuster y Borja Ibáñez, que muestra por primera vez cómo este fenómeno ocurre de forma muy precoz en sujetos aparentemente sanos de edad media.
El corazón es un músculo que necesita un aporte constante de sustratos para una producción constante de energía y así poder contraerse de manera incesante durante toda la vida. Para generar la energía, el corazón utiliza diferentes sustratos que posteriormente convierte en energía, entre los cuales los principales son los ácidos grasos y los carbohidratos (glucosa).
Según este nuevo estudio, la alteración del consumo de sustratos energéticos en el corazón a través de estos factores de riesgo metabólicos podría promover enfermedades, como la insuficiencia cardiaca, que aparecen años después.
Como explica el Dr. Borja Ibáñez, Director científico del CNIC, cardiólogo en el Hospital Universitario Fundación Jiménez Díaz y jefe de grupo en el CIBERCV, “la identificación precoz de los cambios que se producen en el corazón en respuesta a los factores de riesgo nos permitirá avanzar en el conocimiento de los mecanismos que intervienen en el desarrollo de enfermedades como la insuficiencia cardiaca y, eventualmente, poder evitar estas enfermedades de manera muy precoz”.
En el estudio, añade el Dr. Ibáñez, “hemos visto que las personas con esta alteración metabólica en el corazón tienen datos de resistencia a la insulina (el estadio más precoz de la diabetes), lo que nos indica que el propio corazón se vuelve menos sensible a la función de la insulina y, por tanto, es incapaz de incorporar glucosa de manera normal. Estudios mecanísticos en marcha en el CNIC deben confirmar que este es el mecanismo fundamental de este daño precoz”.
En este sentido, explica Ana Devesa, primera firmante del artículo e investigadora del CNIC, que los factores de riesgo que producen la alteración de la utilización de energía en el corazón son los relacionados con el síndrome metabólico: obesidad central (perímetro de la cintura aumentado), triglicéridos altos, colesterol HDL bajo, glucosa en sangre elevada, resistencia a la insulina y tensión arterial alta.
“Además de los factores de riesgo – señala la Dra. Devesa – observamos que aquellos con alteración en el consumo energético del corazón tienen más frecuentemente aterosclerosis en fases tempranas”.
Este trabajo se ha realizado dentro del estudio PESA CNIC-SANTANDER, un proyecto conjunto entre el CNIC y el Banco Santander que se inició hace más de 10 años.
Como explica el Dr. Valentín Fuster, “PESA es el proyecto buque insignia del CNIC, ya que alrededor del estudio trabajan muchos de los grupos de investigación punteros del centro, cada uno experto en un área concreta de la enfermedad cardiovascular. Combinar la participación de investigadores básicos y clínicos alrededor de una gran cohorte como PESA es algo único en el mundo”.
El estudio ha contado con el apoyo de la Comisión Europea, del Ministerio de Ciencia e Innovación y de la Comunidad de Madrid.
NATURE COMMUNICATIONS
Descubren una terapia para la enfermedad cardíaca responsable de hasta un 20% de las muertes súbitas en deportistas

Un equipo del CNIC ha descubierto un posible tratamiento para una enfermedad que causa la muerte de deportistas de élite sin preaviso: la Cardiomiopatía Arritmogénica, una enfermedad incurable del músculo cardíaco a la que se atribuyen hasta un 20% de las muertes súbitas documentadas en atletas.
Dirigido por el Dr. Juan A. Bernal, director de la Unidad de Vectores Virales del CNIC, este equipo ha descubierto un tratamiento para recuperar la capacidad de contracción del músculo cardíaco en modelos de Cardiomiopatía Arritmogénica.
Estudiando mutaciones en la proteína Placofilina-2 (PKP2), que provocan esta afección, describen por primera vez una función desconocida hasta el momento de la proteína PKP2 que controla la unión funcional de las células musculares del corazón. Estos resultados se han publicado en la revista Nature Communications.
Dos componentes patológicos principales caracterizan la Cardiomiopatía Arritmogénica; por un lado, los problemas de contracción cardíaca, y, por otro, arritmias ventriculares malignas. Como consecuencia, estos pacientes pueden sufrir eventos adversos como sincopes o incluso muerte súbita, frecuentemente asociados a episodios de ejercicio extremo.
Como comenta el investigador responsable de la publicación, Juan A. Bernal, “nuestro trabajo se centra en estudiar el problema muscular del corazón en esta enfermedad. Hacerlo nos ha permitido entender por qué las células musculares del corazón no se contraen adecuadamente y, además, cómo solucionarlo. Entender el funcionamiento de esta patología es esencial para desarrollar nuevos tratamientos inexistentes hasta la fecha”.
Hasta el momento se han descrito más de 350 mutaciones en la proteína PKP2, “pero no sabemos cuáles de ellas son patológicas, y si lo son, si serán más o menos agresivas”, asegura el investigador del CNIC. Lo que sí sabemos, desde hace unos años, “es que el ejercicio extremo acelera el desarrollo de la enfermedad”, como ya demostró el grupo del Dr. Bernal hace unos años.
Aunque se está lejos de entender completamente las bases moleculares de esta afección, este trabajo identifica un grupo de mutantes que siempre se asocian con problemas contráctiles graves y que responden al tratamiento farmacológico con un activador de las miosinas reguladoras, el 4-hidroxiacetofenona (4-HAP).
“Los resultados son una prueba de concepto que demuestra que generar un atlas completo de todas las mutaciones de PKP2 y poder categorizar qué pacientes son susceptibles de sufrir un síncope o una muerte súbita, es posible, y que casos como el de Antonio Puerta (Sevilla F.C., 2007), podrían ser evitables en el futuro”, enfatiza la Dra. Nieves García-Quintáns, primera autora de la publicación.
“Nuestro trabajo en busca de tratamientos para esta terrible enfermedad, que se ceba con jóvenes deportistas, no hubiera sido posible sin la aportación público-privada del CNIC, el Ministerio de Ciencia, Innovación y Universidades, la Fundación Bancaria “la Caixa”, o la Cátedra Real Madrid-Universidad Europea”, añade el Dr. Bernal.
NATURE COMMUNICATIONS
Desvelan un papel clave de un tipo de células implicadas en la respuesta inmune y en el diseño de vacunas
Un equipo de investigadores del CNIC y del Hospital de la Princesa-UAM descubrió que un tipo de células implicadas en la respuesta inmune ante virus, bacterias, etc., las células dendríticas, también se encuentran implicadas en dicho proceso, pero de una manera desconocida hasta la fecha.
El estudio que se publicó en la revista Nature Communications, liderado por el Prof. Francisco Sánchez-Madrid, aporta información valiosísima sobre los mecanismos implicados en la respuesta inmune del organismo ante patógenos y abre una nueva vía para diseñar vacunas innovadoras frente a futuras pandemias.
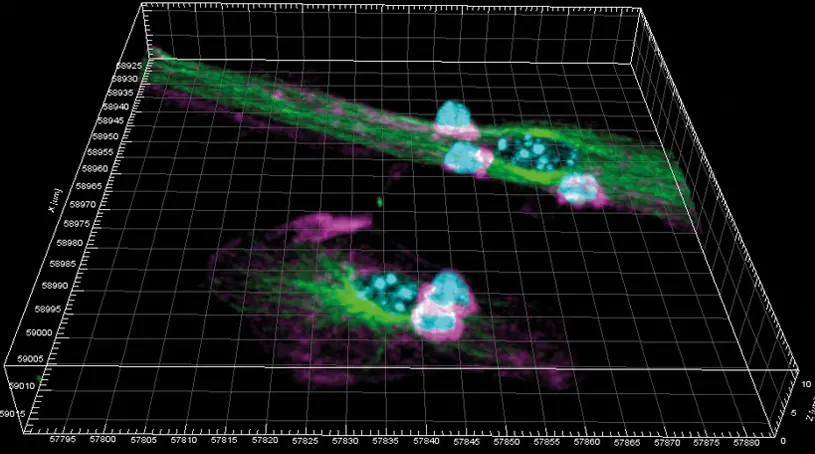
Cuando un agente infeccioso entra en nuestro organismo, el sistema inmunitario responde para eliminarlo. Concretamente, explica el Dr. Diego Calzada Fraile, primer autor del artículo, “las células dendríticas, que actúan como centinelas en nuestros tejidos, son capaces de detectar y fagocitar o absorber al patógeno, y degradarlo en fragmentos pequeños para mostrarlos en su superficie a los linfocitos, células efectoras del sistema inmune, que lo reconocen y lo atacan de forma específica”.
Este proceso, denominado presentación antigénica, implica un contacto estrecho entre ambos tipos celulares para formar una estructura dinámica, denominada sinapsis inmunitaria, a través de la que intercambian información.
En este estudio, se desvela que, tras la formación de la sinapsis inmunitaria, no sólo se activan los linfocitos como ya se conocía, sino que también las células dendríticas (postsinápticas) sufren profundos cambios.
En la investigación se describen alteraciones muy relevantes en el contenido de las proteínas en la célula dendrítica postsináptica. Además, añade el Dr. Calzada Fraile, “hemos identificado un mecanismo inducido en las células dendríticas, basado en un aumento de la peroxidación lipídica mediante el cual los antígenos de los patógenos fagocitados son presentados más eficientemente a los linfocitos CD8 citotóxicos”.
Los estudios in vivo realizados en colaboración con la Universidad de Padua (Italia), en un modelo de ratón han permitido seguir, estudiar y manipular las células dendríticas postsinápticas que han interaccionado con linfocitos T in vivo durante una respuesta inmune, como la que se produce durante la vacunación con un antígeno formulado en alum, el adyuvante más usado en vacunas humanas.
Hemos visto, señala el Prof. Francisco Sánchez-Madrid, “que estas células dendríticas post- sinápticas son responsables de la generación de linfocitos CD8 específicos frente a la vacuna”. Por tanto, “proponemos intervenir en estas células como una forma de aumentar las respuestas de las células CD8 durante la vacunación”.
En su opinión, la importancia de este hallazgo reside en el hecho “de que es de suma importancia que las vacunas sean capaces de generar grandes respuestas CD8, determinantes en la protección de muchas infecciones”.
Con estas mayores capacidades para activar a los linfocitos T CD8 citotóxicos, los autores han demostrado que las células dendríticas postsinápticas se pueden administrar in vivo y así proteger al organismo frente a infecciones bacterianas y virales, actuando a modo de una vacuna frente a diversos patógenos.
Además, en este caso, “la protección no depende de la inclusión de los microorganismos como sucede en las vacunas tradicionales, por lo que se podría emplear para proteger frente a patógenos desconocidos que puedan surgir y causar nuevas pandemias”.
El estudio ha sido, en parte, financiado por el proyecto de la Caixa Health Research HR17-00016 (FS-M), y por la beca pre-doctoral INPhINIT Retaining Fellowship de la Fundación “la Caixa” (DC-F).
CIRCULATION RESEARCH
Desvelan el papel clave de una proteína en la correcta formación del corazón
Un equipo de investigadores del CNIC identificó un actor clave en el proceso de formación del corazón. En concreto, en un estudio que se publicó en Circulation Research, el equipo dirigido por el Dr. José Luis de la Pompa desveló el papel vital de una proteína, Neuregulina-1 (Nrg1), en el fascinante viaje que transforma el corazón como estructura delicada hasta un órgano fuerte y palpitante.
Los hallazgos no solo resaltan las vías a través de las cuales se forma el corazón humano, sino que además ofrecen pistas esenciales para futuros avances médicos.
El corazón es el motor de nuestro cuerpo, y para funcionar de forma correcta depende de partes especializadas como los ventrículos, cámaras esenciales del corazón y responsables de sus latidos rítmicos, que desempeñan un papel crucial al bombear sangre a lo largo de toda nuestra vida.
Desde hace tiempo, los científicos sienten una profunda curiosidad por cómo estas cámaras vitales, inicialmente estructuradas como finas capas llamadas trabéculas, crecen y maduran hasta convertirse en las sólidas estructuras que mantienen nuestros corazones latiendo.
Las trabéculas, explica Joaquín Grego-Bessa, primer autor del estudio, son como el andamiaje del corazón, proporcionando soporte a medida que crece. Comprender cómo estas estructuras evolucionan hacia ventrículos maduros no solo es fascinante para los biólogos, sino que también tiene un inmenso potencial para la medicina regenerativa, ofreciendo posibles perspectivas sobre condiciones relacionadas con el corazón y tratamientos.
Los investigadores han identificado un actor clave en este proceso: Nrg1, una proteína señalizadora que guía la formación de las trabéculas. Sin embargo, los intrincados mecanismos mediante los cuales Nrg1 opera y su papel en la maduración de las paredes del corazón siguen siendo un enigma.
Para resolver este misterio, los científicos del CNIC realizaron experimentos utilizando técnicas avanzadas de imagen, análisis genético y estudios bioquímicos en ratones. Manipulando los niveles de Nrg1 específicamente en las células cardíacas, observaron patrones fascinantes.
“Los experimentos demostraron que Nrg1 actúa como un director de orquesta que coordina una sinfonía de eventos dentro de las células cardíacas”, explica Donal MacGrogan, coautor senior de este estudio. Así, añade, “influye en la forma en que las células cardíacas se dividen y forman trabéculas, asegurando que crezcan en la dirección correcta”.
Los científicos lo imaginan como una mano guía que moldea la arquitectura del corazón. En la investigación se observó que, cuando se alteraron los niveles de Nrg1, las células cardíacas se comportaron de manera diferente, lo que causó irregularidades en su estructura y función. Estos cambios son similares a un tropiezo en el proceso de crecimiento del corazón, lo que podría provocar problemas cardíacos en esa persona en el futuro.
José Luis de la Pompa subraya que comprender cómo funciona Nrg1 no es solo una búsqueda intelectual, sino que “podría allanar el camino para tratamientos revolucionarios en el futuro”.
Así es, añade, ya que, al descifrar el lenguaje del desarrollo cardíaco, “se podrían desbloquear nuevas estrategias para reparar corazones dañados. Esta investigación no solo profundiza nuestro conocimiento sobre cómo crecen y funcionan nuestro cuerpo -destaca-, sino que también brinda esperanza a quienes luchan contra las enfermedades del corazón”.
La investigación ha contado con el apoyo del Ministerio de Ciencia e Innovación, CIBER CV, la Fundación BBVA, Fundació La Marató de TV3, la Sociedad Española de Cardiología y el Programa Atracción de Talento de la Comunidad de Madrid.
JACC
Las personas jóvenes son más vulnerables al dañino efecto del colesterol y la tensión arterial elevada
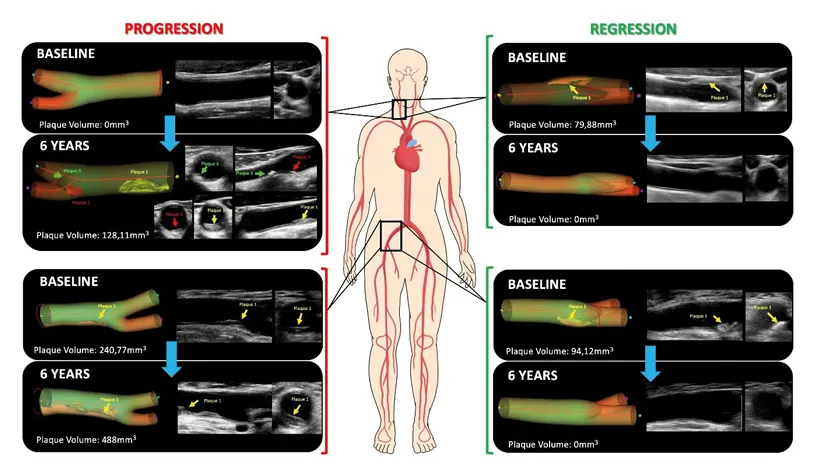
Las personas jóvenes podrían ser más susceptibles al efecto dañino de los factores que favorecen la aterosclerosis. Según una investigación del CNIC, estas personas son más vulnerables a los efectos perjudiciales que conllevan dos de estos factores: el colesterol y la tensión arterial elevados.
Estos resultados se publicaron en la revista JACC y subrayan la necesidad de que el control agresivo de los factores de riesgo debería comenzar en edades más tempranas de la vida.
La aterosclerosis subclínica a menudo progresa en personas de mediana edad, especialmente cuando los niveles de LDL-colesterol y la tensión arterial están elevados, incluso de manera ligera o moderada. Tanto la comunidad médica como la sociedad deberían ser conscientes de que la aterosclerosis es una enfermedad que puede detener su progresión si se gestionan de manera agresiva los factores de riesgo desde temprana edad.
Por ello, subraya el D. Valentín Fuster, Director General del CNIC, “un cribado de la aterosclerosis subclínica desde temprana edad, así como el control agresivo de los factores de riesgo podría ayudar a aliviar la carga global de enfermedades cardiovasculares”.
El estudio subraya la necesidad de cambiar las estrategias de prevención primaria debido a que las arterias son más vulnerables al efecto dañino de estos factores en edades jóvenes.
El Dr. Borja Ibáñez, director científico de CNIC, explica que “en este trabajo hemos identificado, entre otros hallazgos, que el impacto de niveles de colesterol y tensión arterial moderadamente elevados en la progresión de la aterosclerosis son mucho más marcados en personas jóvenes que en las más mayores”.
Existen pocos estudios en el mundo que evalúen la presencia de aterosclerosis silente, es decir, en personas totalmente asintomáticas, en personas jóvenes o de edad media aparentemente sanas y cómo esta enfermedad progresa a lo largo de la vida.
El estudio PESA-CNIC-Santander (Progression of Early Subclinical Atherosclerosis) se inició en el año 2009 y es fruto de la colaboración estrecha entre en CNIC y el Banco de Santander.
En relación con la prevención, este estudio nos muestra que el control de los factores de riesgo (principalmente colesterol y tensión arterial) debería de iniciarse en edades muy tempranas, momento en el que las arterias son más vulnerables al efecto dañino de estos factores.
La cardióloga Guiomar Mendieta, primera firmante del trabajo, añade que “otro de los grandes hallazgos de este trabajo es que la aterosclerosis, que se había considerado hasta ahora un fenómeno progresivo irreversible, puede desaparecer si se controlan los factores de riesgo de forma temprana”.
La contribución de los investigadores del CNIC al estudio ha sido financiada por la Comisión Europea (ERC-CoG 819775 y H2020-HEALTH 945118), el Ministerio de Ciencia e Innovación de España (PID2019 110369RB I00) y la Comunidad de Madrid (P2022/BMD-7403, RENIM-CM).
NATURE CARDIOVASCULAR RESEARCH
Descubren una prometedora diana terapéutica para las arritmias cardíacas
Un estudio llevado a cabo por los equipos de Guadalupe Sabio y José Jalife en el CNIC ha descubierto una nueva vía de señalización que estaría detrás de la aparición de la fibrilación ventricular, un tipo de arritmia cardiaca. El trabajo, publicado en Nature Cardiovascular Research ofrece nuevas esperanzas para abordar enfermedad.
La fibrilación ventricular es la principal causa inmediata de muerte súbita cardiaca. El corazón late de manera regular y coordinada para bombear sangre de manera eficiente a través del cuerpo. Para ello tiene que coordinar la contracción de todas sus células y cada latido tiene que seguir un patrón meticulosamente orquestado. Cuando aparece una arritmia, el ritmo cardiaco se altera, se acelera, se vuelve irregular y es potencialmente mortal.
Estudiando modelos animales, los investigadores del CNIC descubrieron la relación existente entre las proteínas quinasas del estrés p38 y p38 y el desarrollo de la fibrilación ventricular, independientemente del sexo.
Observaron que la activación de p38 y p38 aumentaba en los corazones de ratones envejecidos y aquellos con condiciones genéticas o inducidas por fármacos que predisponían a arritmias, lo que sugería que esta vía tenía un papel crítico en el desarrollo de esta afección.
Según Rafael Romero, primer firmante del artículo e investigador del CNIC, “cuando nos dimos cuenta de que la activación de estas p38 era común en distintas situaciones arritmogénicas, supimos que podían tener un papel clave que había que investigar”.
El estudio exhaustivo de esta vía de señalización reveló que, cuando estas proteínas quinasas se activan, alteran las propiedades eléctricas de los cardiomiocitos, propiciando la aparición de arritmias. Esto sucede por la alteración de unos canales iónicos existentes en las células musculares del corazón responsables de coordinar la contracción celular.
Estos hallazgos podrían abrir nuevas perspectivas para la prevención de la fibrilación ventricular sostenida y la protección contra esta grave afección cardíaca, ofreciendo una prometedora diana terapéutica para futuras investigaciones.
El estudio ha sido financiado por un Proyecto Intramural CNIC Severo Ochoa, un proyecto IMPACT-2021 (PMP21/00057) del Instituto de Salud Carlos III (ISCIII), el Ministerio de Ciencia e Innovación (PDC2021-121147-I00 y PID2019-104399RB-I00), y la Unión Europea (FEDER/FSE), “Una manera de hacer Europa”/ “El FSE invierte en tu futuro”/ Next Generation EU. Además, ha recibido ayudas de la American Heart Association, la Fundació Marató TV3 y la Fundación Bancaria “la Caixa”.
CIRCULATION RESEARCH
Identifican los mecanismos moleculares que controlan los genes implicados en la correcta formación de las válvulas cardíacas

Un equipo de investigadores del CNIC ha identificado los mecanismos moleculares que controlan la actividad de genes implicados tanto en la correcta formación de las válvulas cardíacas como en la prevención de su posterior calcificación.
Los hallazgos, que se publicaron en la revista Circulation Research, no solo resaltan las vías a través de las cuales se forma el corazón humano, sino que además ofrecen pistas para futuros avances médicos. Así, asegura el Dr. José Luis de la Pompa, jefe del Laboratorio de Señalización Intercelular en el Desarrollo y la Enfermedad Cardiovascular en el CNIC y coordinador del estudio, “al comprender estos procesos fundamentales, los científicos se acercan un paso más para resolver los misterios del corazón humano y de sus patologías”.
El corazón es el motor de nuestro cuerpo y para funcionar de forma correcta depende de partes especializadas. Uno de estos componentes es el endocardio, la monocapa de células que recubre el interior del corazón, aislando al músculo cardíaco de la sangre que bombea hacia todo el cuerpo.
“Pero ésta no es su única función”, explica el Dr. Luis Luna Zurita, autor principal de este trabajo y corresponsable del mismo: “Este revestimiento interno del corazón produce señales moleculares que aseguran la correcta organización y función del corazón durante el desarrollo embrionario”.
Por ejemplo, el papel del endocardio en la formación de las válvulas cardíacas es esencial.
“En respuesta a distintas señales, células específicas de ciertas regiones del endocardio se transforman, adquieren propiedades invasivas y colonizan un territorio debajo del miocardio, formando gradualmente unas estructuras llamadas primordios valvulares, que experimentan un proceso progresivo de modelado hasta dar lugar a las válvulas adultas funcionales”, señala el Dr. Luna Zurita.
Las válvulas cardíacas son estructuras cruciales en el sistema cardiovascular y se encargan de regular el flujo sanguíneo unidireccional en el corazón. “La válvula aórtica es una de las cuatro válvulas del corazón y se encuentra entre el ventrículo izquierdo y la arteria aorta. Se sabe que en aproximadamente un 1% de la población, dicha válvula presenta solo dos valvas (válvula aórtica bicúspide, BAV en inglés) en lugar de tres (TAV), que sería la situación normal en humanos”, expone el Dr. De la Pompa.
Esta válvula bicúspide es más proclive a deteriorarse y da lugar a diferentes patologías cardiovasculares. Entre ellas se incluye la calcificación valvular, que afecta en gran medida a estos pacientes, pero también a individuos sin malformaciones valvulares aparentes.
Durante este proceso, se acumulan depósitos de calcio en la válvula aórtica, afectando a su flexibilidad y función. Esta calcificación provoca la estenosis valvular, dificultando el flujo sanguíneo y comprometiendo la capacidad de bombeo del corazón, “por lo que la válvula calcificada ha de ser sustituida quirúrgicamente”, comenta el Dr. de la Pompa.
Desde hace tiempo se ha demostrado que la vía de señalización NOTCH, muy conservada evolutivamente, desempeña un papel fundamental en las diferentes etapas del desarrollo cardiovascular, como los estudios en distintos modelos experimentales han revelado. Cuando experimenta una perturbación, asegura el Dr. De la Pompa, “es responsable, tanto de la malformación valvular, como de su calcificación”.
Ahora, mediante el uso células de endocardio embrionario previamente aisladas y la manipulación controlada de la actividad de la vía de señalización NOTCH, se describe por primera vez los programas génicos activados e inhibidos por dicha vía en el endocardio, distinguiéndose entre una respuesta temprana y una respuesta tardía.
Así, tras generar estos datos de expresión génica, el Dr. Luna Zurita, los comparó con programas genéticos previamente descritos por el laboratorio del Dr. la Pompa. “Estos datos corresponden al proceso de desarrollo embrionario y calcificación de válvulas adultas, permitiendo este análisis la identificación tanto de genes cuyo apagado impide la correcta formación de las válvulas, como aquellos genes cuya inhibición está directamente relacionada con el proceso de calcificación, y genes cuya ausencia afecta negativamente a ambos procesos”, asegura el Dr. Luna Zurita.
Además, la investigación ha identificado un conjunto de regiones reguladoras que actúan sobre estos genes. Explica el Dr. Luna Zurita que mientras que los genes suponen el 1% del ADN, es en el 99% restante donde se encuentran sus regiones reguladoras, las cuales son responsables de que un gen se exprese en un órgano específico y en un momento determinado. “Esto implica que, si la identificación de los genes es muy relevante para entender y tratar la enfermedad, la localización de sus regiones reguladoras lo es igualmente. Analizando los cambios de compactación del ADN, se identificaron aquellas regiones que se abren o cierran tras la actividad de la vía de NOTCH”.
El análisis bioinformático de las mismas y la integración de diferentes bases de datos de estudios previos permitió a los investigadores identificar las regiones del ADN con mayor probabilidad de controlar la expresión de los genes previamente identificados durante la formación y mantenimiento de las válvulas cardíacas, así como las moléculas y vías de señalización encargadas de dicho control.
“Así hemos descubierto que la cooperación de NOTCH con la vía de señalización HIPPO, una de las vías más estudiadas en los últimos años y crucial para el control de la división celular y el tamaño de los órganos. Este trabajo describe por primera vez la relevancia de la interacción en ambas vías para que el endocardio participe de forma correcta en la formación de las válvulas”, añade el Dr. De la Pompa.













