Nature Genetics: Los cambios epigenéticos en los interruptores genéticos son cruciales para la construcción de los vertebrados
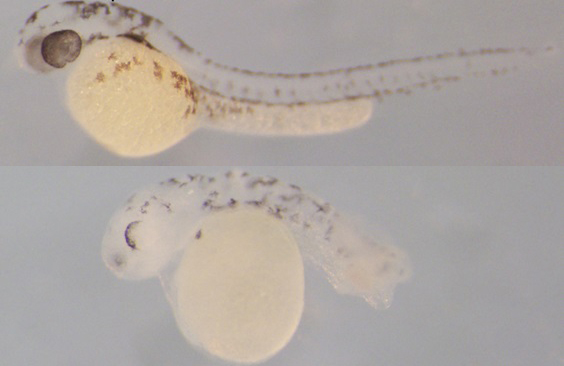
Pruebas con peces cebra han mostrado que el fallo de este proceso causa un desarrollo embrionario defectuoso
Los interruptores genéticos regulan la activación de los genes durante el desarrollo embrionario para controlar la generación de tejidos y órganos. Un fallo en estos interruptores puede ocasionar diversas enfermedades. Ahora un nuevo estudio ha demostrado que para que funcionen correctamente un grupo de estos interruptores -los que encienden los genes para la construcción de las estructuras de los vertebrados- deben sufrir una modificación epigenética (una alteración de la actividad del ADN que no modifica su secuencia) durante el desarrollo embrionario. Este cambio está evolutivamente conservado en todos los vertebrados y es esencial para establecer el plan corporal que comparten todos los animales de este linaje. El estudio, publicado en la revista Nature Genetics, ha sido desarrollado por un grupo internacional de científicos del Consejo Superior de Investigaciones Científicas (CSIC), la Universidad de Australia Occidental y la Universidad Radboud de Nimega (Holanda).
“La construcción de un organismo durante el desarrollo embrionario es un proceso complejo por el cual las células por un lado se multiplican y por otro generan diferentes tipos celulares. Esto se lleva a cabo con el encendido y apagado controlado de diferentes genes en los distintos territorios embrionarios. El resultado de esta activación diferencial de genes es la formación de diferentes tejidos y órganos. ¿Cómo se orquesta este proceso de activación controlada de genes? En el genoma solo un 2% de la información está destinada a los genes, el resto del ADN alberga millones de interruptores que controlan de forma muy precisa cuándo, cuánto y dónde se encienden los genes”, explica uno de los autores responsables de este trabajo, el investigador del CSIC José Luis Gómez-Skarmeta del Centro Andaluz de Biología del Desarrollo (centro mixto del CSIC, la Junta de Andalucía y la Universidad Pablo de Olavide) en Sevilla.
Muchas enfermedades humanas se deben a fallos en estos interruptores, tanto en las etapas embrionarias causando malformaciones o incluso en adultos, causando cáncer u otras enfermedades como obesidad y diabetes.
Este trabajo demuestra que para que funcionen correctamente un grupo de estos interruptores durante el desarrollo embrionario, deben perder una marca epigenética que los mantiene apagados, la metilación del ADN.
“Lo más interesante es que estos interruptores que pierden la metilación (se desmetilan) están conservados entre todos los vertebrados y son responsables de encender genes críticos para la construcción de las estructuras embrionarias comunes a todos los vertebrados, incluyendo nosotros los humanos”, indica el primer autor del trabajo Ozren Bogdanovic, ex miembro del grupo del doctor Gómez Skarmeta y ahora investigador en la Universidad de Australia Occidental.
El estudio también describe el mecanismo molecular por el cual estos interruptores se desmetilan, y ha identificado a las proteínas de la familia Tet como elementos críticos de este proceso. De hecho, el bloqueo de la actividad de estas proteínas en peces cebra impide la desmetilación de estos interruptores, reduciendo su actividad y causando un desarrollo embrionario defectuoso.
“Estudios futuros nos permitirán saber si el fallo de este proceso está también asociado a enfermedades humanas”, concluye Gómez Skármeta.
En este trabajo también participan científicos del Centro Nacional de Investigaciones Cardiovasculares de Madrid (CNIC), científicos de Oxford en el Reino Unido, científicos de la Universidad de Münich en Alemania y del Instituto Salk de EEUU.
Bogdanović O, Smits AH, de la Calle Mustienes E, Tena JJ, Ford E, Williams R, Senanayake U, Schultz MD, Hontelez S, van Kruijsbergen I, Rayon T, Gnerlich F, Carell T, Veenstra JGC, Manzanares M, Sauka-Spengler T, Ecker JR, Vermeulen M, Gómez-Skarmeta JL, Lister R. Active DNA demethylation during the vertebrate phylotypic period. Nature Genetics. Doi: 10.1038/ng.3522