EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas
científicas publican
investigaciones
de los laboratorios del CNIC
NATURE
Descubren tipos de comportamiento celular capaces de predecir la enfermedad cardiovascular

Investigadores del CNIC han diseñado un modelo para estudiar el comportamiento de células inmunes en organismos vivos, y descubren uno ‘perjudicial’ que se asocia a enfermedades cardiovasculares. Liderados por el Dr. Andrés Hidalgo, los científicos han descubierto que los neutrófilos, un tipo de células inmunes, adquieren diferentes ‘comportamientos’ en la sangre durante los procesos inflamatorios. En concreto, el estudio que se publica en Nature identifica una conducta asociada con las enfermedades cardiovasculares. La información puede permitir el desarrollo de nuevos tratamientos para minimizar las secuelas ocasionadas por los infartos de miocardio.
Los neutrófilos constituyen la principal línea de defensa del organismo, pero también son capaces de causar daño a las células sanas y al sistema cardiovascular. Los investigadores buscaron identificar tipos específicos de neutrófilos responsables del daño vascular. Analizaron el comportamiento de las células utilizando microscopía intravital de alta resolución, un tipo de tecnología que permite visualizar células dentro de los capilares sanguíneos en animales vivos.
El equipo diseñó un sistema computacional altamente novedoso capaz de analizar cómo se comportan las células en los vasos mediante mediciones simples de cambios de tamaño, forma y movimiento de las células. Descubrió así que dichas células inmunes exhiben tres patrones de conducta durante el transcurso de los procesos inflamatorios, pero que solo una de ellas, caracterizada por un mayor tamaño y proximidad a las paredes de los vasos, estaba asociada al daño cardiovascular.
Los autores utilizaron este sistema computacional para identificar las moléculas responsables de dichos comportamientos nocivos de los neutrófilos.
Los estudios demostraron que una única molécula, Fgr, es la responsable de este comportamiento patológico, lo que a su vez fue clave para seleccionar un fármaco de una gran eficacia para prevenir la inflamación y la muerte celular tras un infarto de miocardio. “La idea ahora es continuar con los ensayos necesarios para que, en un futuro, se pueda utilizar este tratamiento en pacientes”, señaló la primera autora del estudio, Georgiana Crainiciuc.
El estudio no solo supone un gran paso a la hora de tratar enfermedades cardiovasculares, también es un hito por la metodología desarrollada para el estudio de células inmunes. “Nuestro modelo es único porque permite identificar células no por su posible perfil genético, sino por su tipo de actividad durante la enfermedad”, indicó el Dr. Miguel Palomino-Segura, coprimer autor del estudio.
“Un aspecto clave es que los neutrófilos son capaces de cambiar su forma, actividad y capacidad migratoria en cuestión de segundos. Esta rápida metamorfosis solo puede ser capturada bajo el microscopio”, añade el Dr. Hidalgo. Para extraer todo el potencial de estas imágenes, los investigadores han colaborado con ingenieros de la Universidad Carlos III de Madrid, que han desarrollado nuevas técnicas de visión artificial para medidas en tejidos vivos.
Con esta nueva metodología, los autores esperan que otros ámbitos científicos se beneficien de su trabajo. “La idea ahora es aplicarlo a otros escenarios como infecciones o tumores, en los que las células inmunes también juegan un papel crucial en el desarrollo de la enfermedad”, indicó Palomino-Segura.
En el estudio han participado investigadores de Fundación Vithas, la Universidad de Castilla-La Mancha, la Agencia de Ciencia y Tecnología de Singapur (ASTAR) y las Universidades de Harvard y Baylor, ambas en EE.UU., entre otros centros.
Asimismo, la investigación ha recibido apoyo de las siguientes entidades financiadoras: Ministerio de Ciencia e Innovación; Fundación “la Caixa”; Fundación Leducq; FET-OPEN European Commission; Federation of European Biochemical Societies y EMBO ALTF.
Nature Cardiovascular Research
Las mutaciones adquiridas en células sanguíneas como un nuevo factor de riesgo cardiovascular
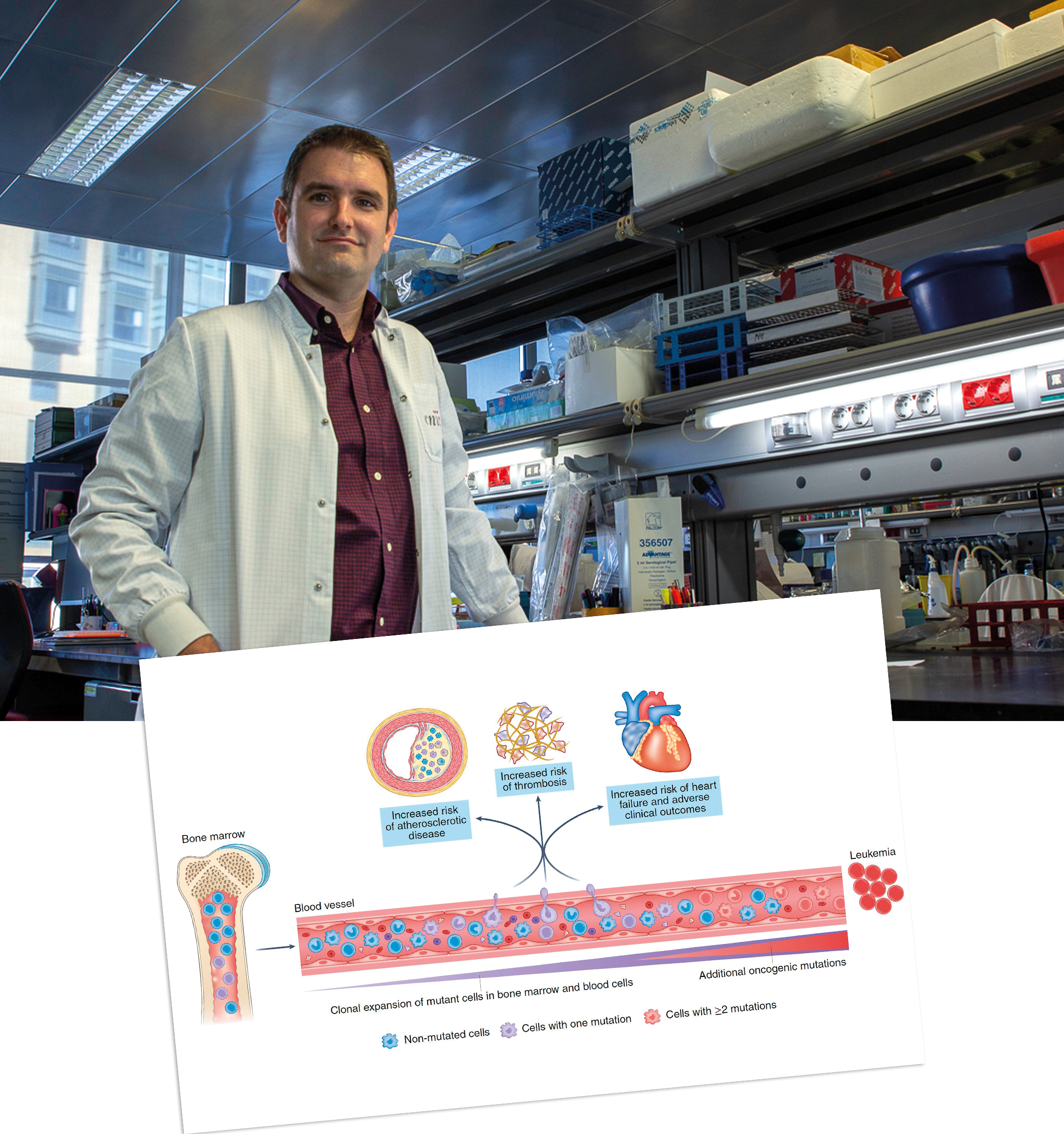
Investigadores del CNIC y la Universidad de Columbia (EE.UU.) revisaron, en un artículo publicado en Nature Cardiovascular Research, el papel de las mutaciones adquiridas y la hematopoyesis clonal en enfermedad cardiovascular.
En el artículo, José Javier Fuster, investigador del CNIC, y el Dr. Alan Tall repasaron los conocimientos actuales del papel de la hematopoyesis clonal en enfermedad cardiovascular, destacando distintas áreas en las que profundizar de cara a traducir estos conocimientos en nuevas herramientas para la prevención o el tratamiento de la enfermedad cardiovascular.
Múltiples estudios en humanos han demostrado en los últimos años que portar mutaciones adquiridas ligadas a hematopoyesis clonal predice un riesgo elevado de múltiples enfermedades cardiovasculares, como infartos cardiacos, ictus o insuficiencia cardiaca. La posibilidad de que dichas mutaciones, que también predicen un mayor riesgo de cáncer hematológico, contribuyan directamente al desarrollo de estas patologías ha sido objeto de debate en el ámbito de la investigación cardiovascular en los últimos años.
En este sentido, experimentos llevados a cabo por los laboratorios de los Dres. Fuster y Tall, entre otros, han demostrado que algunas mutaciones ligadas a hematopoyesis clonal aceleran el desarrollo de la enfermedad cardiovascular al agravar distintas respuestas inflamatorias.
En esta revisión, los autores desmenuzan los distintos mecanismos subyacentes a esta inflamación aumentada. “Profundizar en estos mecanismos podría, en un futuro, dar lugar a estrategias personalizadas de prevención de la enfermedad cardiovascular, dirigidas específicamente a paliar los efectos proinflamatorios de estas mutaciones”, asegura José Javier Fuster.
Se sabe desde hace años que la inflamación juega un papel clave en el desarrollo de la enfermedad cardiovascular, pero esto no se ha traducido en el uso generalizado de tratamientos antiinflamatorios para la prevención de esta patología. Estos tratamientos, matiza el investigador del CNIC, 0deberían aplicarse únicamente en contextos concretos, puesto que podrían conllevar un aumento del riesgo de infecciones.
En este sentido, “la detección de mutaciones adquiridas ligadas a hematopoyesis clonal podría ayudar a identificar a aquellas personas que podrían beneficiarse en mayor medida de un tratamiento antiinflamatorio, al presentar una inflamación exacerbada, e informar de qué tratamiento específico podría ser especialmente efectivo”.
Los Dres. Fuster y Tall son miembros de la Red Internacional sobre hematopoyesis clonal y aterosclerosis financiada por la Fundación Leducq, que engloba varios grupos pioneros en este campo y en la que también participa el grupo del investigador del CNIC Andrés Hidalgo.
Circulation
Un estudio advierte sobre los riesgos de las técnicas de terapia con mitocondrias
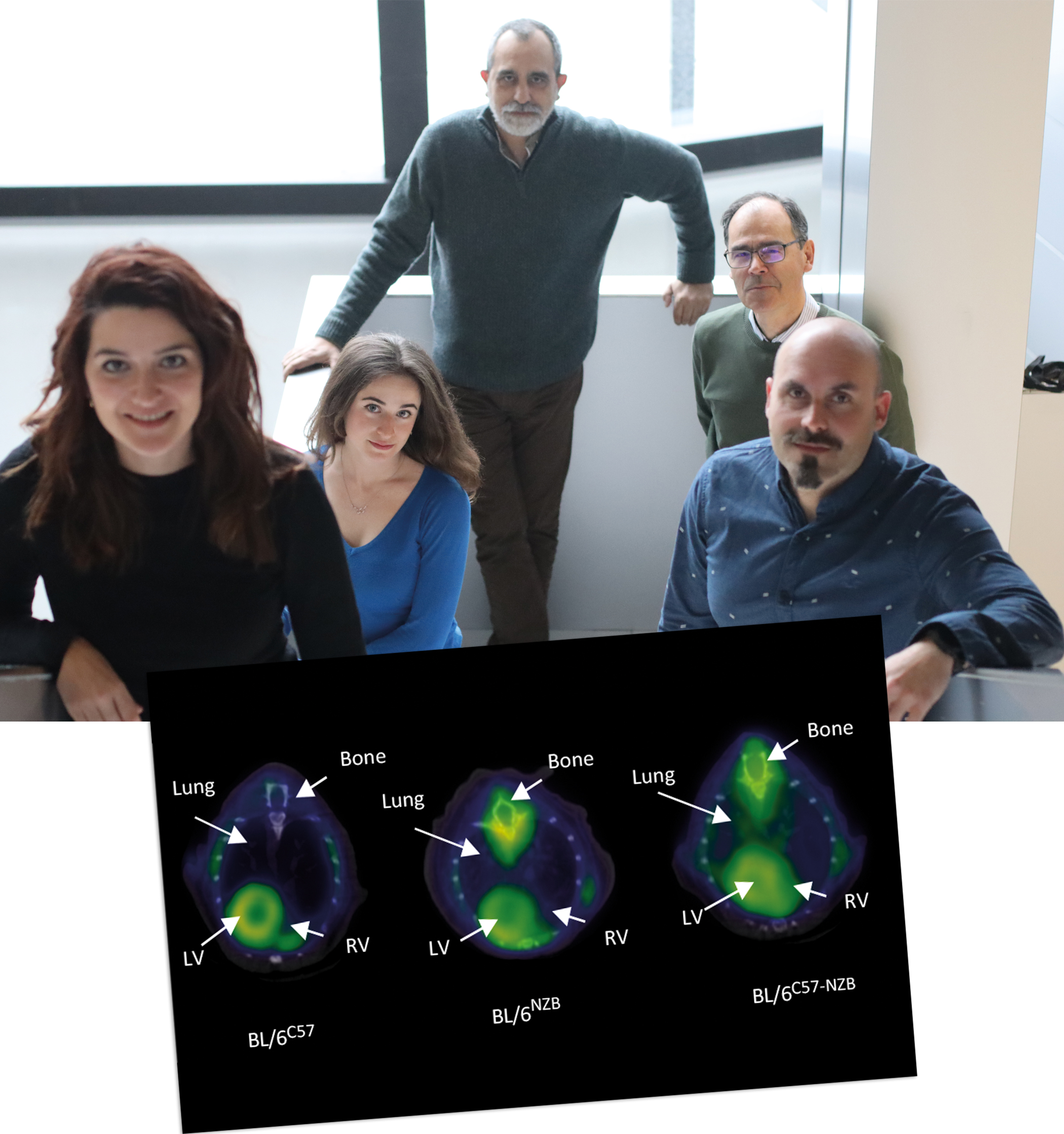
La mezcla de ADN mitocondrial (ADNmt) de dos orígenes diferentes puede tener efectos perjudiciales a largo y medio plazo, asegura una investigación publicada en Circulation y realizada por un equipo del CNIC, en colaboración con un grupo del CIC biomaGUNE. El ADNmt forma parte del material genético transmitido únicamente desde las madres a su descendencia.
La investigación aporta una información valiosísima para comprender y evitar los posibles riesgos de las técnicas terapéuticas que implican transferencia mitocondrial. Entre estas, las más populares son las técnicas diseñadas a mejorar la fertilidad mediante la inyección de mitocondrias procedentes de un óvulo donante en el óvulo de la mujer con problemas de fertilidad o el reemplazo mitocondrial, destinada a evitar la trasmisión de mutaciones patológicas a la descendencia, popularmente conocida como “hijos de tres padres genéticos”.
Según el estudio, aunque la mayoría de las células rechazaban tener dos variantes mitocondriales y eliminaban progresivamente uno de los dos ADNmt, algunos órganos tan importantes como el corazón, el pulmón o el músculo esquelético, eran incapaces de hacerlo.
Para el Dr. José Antonio Enríquez, líder de la investigación y director del laboratorio de Genética Funcional del Sistema de Fosforilación Oxidativa (GENOXPHOS) del CNIC, la información es especialmente relevante para el campo de las terapias de transferencia mitocondrial de donantes, debido a que, en el trabajo, “se ha visto que los animales aparentemente sanos en su etapa juvenil sufrían a largo plazo fallo cardiaco, hipertensión pulmonar, pérdida de masa muscular, fragilidad y muerte prematura”.
La mayor parte del ADN de las células de nuestro cuerpo se encuentra organizado en el núcleo de la célula. Es allí donde se localiza la información para aproximadamente 20.000 genes del genoma humano. Sin embargo, explicó el Dr. Enríquez, 37 genes no se ubican en el núcleo de las células: “Están situados en unos compartimentos celulares llamados mitocondrias, donde reside el ADN mitocondrial”.
El ADN del núcleo se transmite de padres a hijos, contribuyendo la madre con el 50% y el padre con el otro 50%, mezclándose en la fertilización de un óvulo por un espermatozoide. Pero el ADNmt solo se transmite a través de la madre, ya que las mitocondrias del espermatozoide son destruidas en el interior del óvulo fecundado. Se dice por ello que el ADNmt es transmitido uniparentalmente prácticamente en todos los organismos. Además, el ADNmt está presente en múltiples copias en cada célula, que son fundamentalmente idénticas (fenómeno denominado homoplasmia).
La presencia de más de una variante de ADNmt en la misma célula (heteroplasmia) puede surgir en raras ocasiones de forma natural debido a mutaciones y desencadena distintas enfermedades, explican los investigadores. En este sentido, en los últimos años se han propuesto diversas técnicas médicas destinadas a prevenir enfermedades y mejorar la fertilidad que pueden generar un nuevo tipo de heteroplasmia, como es la popularmente conocida “hijos de tres padres genéticos”.
Los investigadores revelan que el proceso de selección entre ADNmt que conviven en la misma célula depende de su impacto en el metabolismo celular y puede ser modulado tanto por variaciones en la función de diversos genes como por la acción de fármacos o alteración de la dieta de los animales. “Todos estos factores determinan la preferencia del tipo de genoma mitocondrial seleccionado”, escriben.
“La razón por la cual la naturaleza ha elegido que el
ADNmt solo se transmita por un progenitor representa una
pregunta biológica relevante todavía por esclarecer, pero que
hasta ahora no presentaba implicaciones en el ámbito de
la salud”, aseguró la Dra. Ana Victoria Lechuga-Vieco,
primera firmante del artículo. “Sin embargo,
las nuevas terapias médicas pueden romper esa barrera biológica
y generar, voluntaria o involuntariamente, mezclas de
ADNmt procedentes de más de un individuo”. Es decir, hasta la
publicación de estos datos “se desconocía si esta mezcla
tenía o no repercusión en el individuo”, comenta el Dr.
Enríquez, director de la investigación.
Para responder a esta pregunta, el grupo GENOXPHOS generó ratones con un ADN nuclear idéntico, pero que poseían simultáneamente en todas sus células ADNmt procedente de dos individuos distintos que diferían entre sí en su secuencia genética. Pero el análisis de estos animales a lo largo de toda su vida reveló que su función mitocondrial estaba dañada por la convivencia de dos ADNmt distintos en la misma célula, describen en su investigación.
“Los órganos que eran capaces de eliminar una de las dos variantes de ADNmt, como el hígado, recuperaban su metabolismo mitocondrial y salud celular, pero los que no, se deterioraban progresivamente con la edad de los animales”, explicó el Dr. Enríquez.
Como consecuencia, los animales aparentemente sanos en su etapa juvenil sufrían a largo plazo fallo cardiaco, hipertensión pulmonar, pérdida de masa muscular, fragilidad y muerte prematura.
Los investigadores concluyen que los efectos perjudiciales de estas tecnologías médicas observados en este estudio exigen una cuidadosa selección del ADNmt de los donantes para las terapias de reemplazo mitocondrial. Incluso, escriben, “el método más prometedor para el reemplazo de mitocondrias de ovocitos que portan mutaciones patológicas conocidas de ADNmt puede fallar y no se logra un 100% del reemplazo”.
El trabajo muestra además que las células receptoras tienen una gran capacidad para seleccionar y amplificar el ADNmt preexistente, que inicialmente puede ser indetectable, lo que da como resultado una potencial mezcla de ADNmt de dos individuos. “El mismo problema surge cuando se realiza el rejuvenecimiento de ovocitos mediante inyección de citoplasma de donantes”, advirtió el Dr. Enríquez.
Ahora bien, estos riesgos no exigen prescindir de las terapias de reemplazo mitocondrial, recalcó el Dr. Enríquez. De la misma forma que en las transfusiones de sangre o en los trasplantes de órganos se debe vigilar la compatibilidad entre donante y receptor, el Dr. Enríquez recomendó que cualquier estrategia terapéutica que pueda suponer la mezcla de ADNmt sano de dos individuos debería “asegurar la compatibilidad de genomas mitocondriales entre el donante y del receptor”.
La investigación se ha llevado a cabo en colaboración con otros centros, entre los que se encuentran el CIBER de Enfermedades Respiratorias (CIBERES) y el CIBER de Enfermedades Cardiovasculares (CIBERCV), y ha recibido apoyo de las siguientes entidades financiadoras: Ministerio de Asuntos Económicos y Transformación Digital (MINECO); Ministerio de Economía, Industria y Competitividad (MEIC); Human Frontier Science Program; Programa Red Guipuzcoana de Ciencia, Tecnología e Información del Gobierno Vasco, y Departamento de Industria, Innovación, Comercio y Turismo del Programa ELKARTEK
Nature Communications
Identifican una ‘lanzadera’ de proteínas nucleares esencial en el crecimiento y desarrollo de órganos

El crecimiento y la regeneración de los órganos requiere de la entrada al núcleo celular de las proteínas que tienen la función de activar los genes necesarios para que se desempeñen dichos procesos. Investigadores del CNIC, liderados por el Dr. Miguel Ángel del Pozo Barriuso, director del grupo de Mecanoadaptación y Biología de Caveolas del CNIC, y el Dr. Asier Echarri Aguirre, investigador del mismo grupo, han conseguido identificar el mecanismo o lanzadera que introduce dichas proteínas en el interior del núcleo en respuesta a estímulos mecánicos, como las fuerzas hemodinámicas generadas por el flujo vascular en el interior de las arterias, la rigidez tumoral, o la propia locomoción mientras caminamos o practicamos deporte. Los resultados se publicaron en Nature Communications.
La mayoría de procesos biológicos requiere de la entrada al núcleo celular de ciertos factores clave para su regulación. Así, por ejemplo, durante el desarrollo, la regeneración de tejidos tras un traumatismo o infarto, o en las enfermedades cardiovasculares o el cáncer, se producen señales mecánicas a las que las células responden multiplicándose para regenerar el tejido dañado, o reorganizando el medio que las rodea.
Para ello, detallan los investigadores del CNIC, son clave ciertos factores que se activan por estas señales mecánicas y entran en el núcleo, donde encienden o activan los genes necesarios para promover el crecimiento o la regeneración del órgano en cuestión.
“Uno de los más importantes es la proteína YAP”, explicó el Dr. del Pozo Barriuso. “Su entrada al núcleo es un proceso muy controlado; solo debe producirse cuando existe una necesidad determinada. Dicha entrada se produce a través de puertas o poros nucleares que, para poder ser atravesados, necesitan de una lanzadera”.
Lo que hace especialmente interesante a YAP es que, ante un incremento en la fuerza mecánica a la que está sometido el tejido, “se activa y entra en el núcleo, donde enciende varios genes que determinan el crecimiento del órgano en cuestión”, detalló el Dr. Asier Echarri Aguirre, uno de los principales autores de este estudio. “YAP, además, está mutada o alterada en numerosas patologías humanas, lo que la hace aún más interesante”, añade María García, primera autora del estudio.
Sin embargo, a pesar de que YAP ha sido ampliamente estudiada debido a su implicación en la regeneración de órganos, o en patologías tan importantes como la aterosclerosis y el cáncer, la vía de entrada al núcleo y la lanzadera que utiliza YAP eran desconocidas.
Ahora, los científicos del CNIC han identificado esta lanzadera, llamada Importina-7, a la que YAP se sube para entrar en el núcleo de la célula y así inducir el crecimiento celular y, finalmente, del tejido.
Este estudio ha demostrado, además, que YAP monopoliza la lanzadera Importina-7 y dificulta que otros factores puedan subirse a ella y entrar en el núcleo. Por lo tanto, “YAP no solo controla directamente los genes importantes para el crecimiento de órganos, sino que además controla la lanzadera y la entrada al núcleo de otros factores”, escriben.
La información también identificó una nueva diana para el desarrollo de medicamentos orientados a bloquear la lanzadera. Los investigadores lograron bloquear el sobrecrecimiento de órganos de mosca simplemente reduciendo los niveles de la lanzadera Importina-7, ya que esto impide que YAP pueda entrar en el núcleo.
Este hallazgo es relevante en medicina aplicada, ya que, en numerosas patologías como la aterosclerosis, el cáncer o la fibrosis, se produce una entrada masiva y no deseada de YAP al núcleo, lo que contribuye al desarrollo de dichas enfermedades. Por tanto, subrayan los científicos, “bloquear la unión de YAP a Importina-7, evitaría la indeseada entrada de YAP al núcleo y su consiguiente efecto patológico”.
Este estudio, por tanto, identifica una nueva diana para el desarrollo de medicamentos orientados a bloquear la entrada de YAP al núcleo en estas enfermedades, que tienen un enorme coste social y económico.
En este trabajo han participado investigadores del CIBER de Enfermedades Cardiovasculares. Asimismo, la investigación ha recibido apoyo de las siguientes entidades financiadoras: Ministerio de Ciencia, Innovación y Universidades; Agencia Estatal de Investigación (AEI)/European Regional Development Fund (ARDF/FEDER) “A way to make Europe”; Comunidad Autónoma de Madrid; Fundació La Marató de TV3; Fundación“la Caixa”; Asociación Española contra el Cáncer, y European Union’s Horizon 2020 research and innovation programme under the Marie Sklodowska-Curie Actions.
EHJ
La médula ósea está implicada en el desarrollo de la aterosclerosis
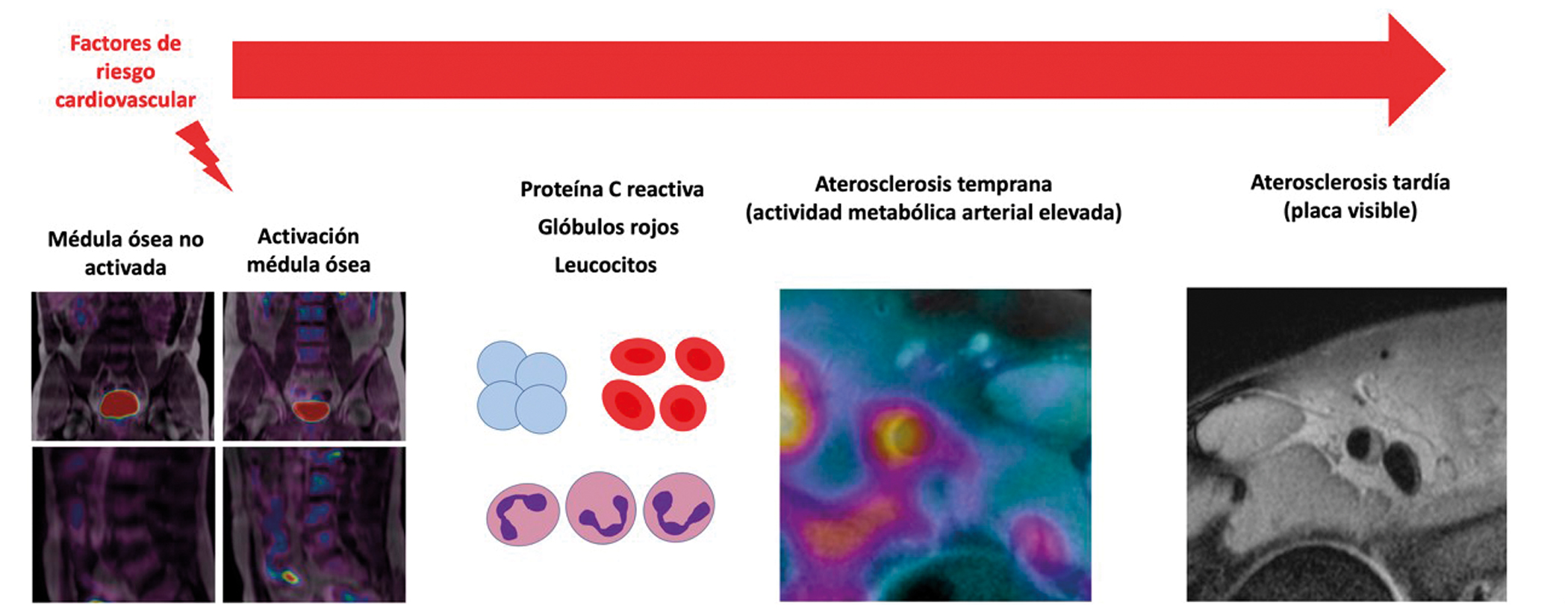
La activación de la médula ósea podría tener un papel fundamental en el origen y desarrollo de las aterosclerosis. Un estudio realizado en el CNIC, liderado por los cardiólogos Valentín Fuster y Borja Ibáñez, sugiere que la médula ósea se activa en respuesta a factores de riesgo cardiovascular. Dicha activación, explican en European Heart Journal, produce un aumento de células inflamatorias en la sangre, las cuales desencadenan un proceso que daría lugar al inicio y posterior progresión de la enfermedad aterosclerótica.
Identificar la enfermedad aterosclerótica en sus fases iniciales (antes de que provoque síntomas) es uno de los principales objetivos del estudio PESA-CNIC-Santander (Progression of Early Subclinical Aterosclerosis), que se inició en el año 2010 como una colaboración entre el CNIC y el Banco de Santander. El estudio cuenta con la participación de 4.200 trabajadores del banco de edad media (40-55 años cuando se incluyeron en el estudio), aparentemente sanos, que son seguidos de forma periódica mediante tecnología de imagen puntera, así como a través de muestras de sangre, donde se realizan estudios de ómicas avanzados. Recientemente se ha extendido el estudio, que durará al menos hasta el año 2029, contando entonces con un seguimiento de casi 20 años en todos los participantes, algo único en el mundo.
Los factores de riesgo que producen la activación de la médula ósea son aquellos relacionados con el síndrome metabólico: obesidad central (perímetro de la cintura aumentado), triglicéridos altos, colesterol HDL bajo, glucosa en sangre elevada, resistencia a la insulina y tensión arterial alta.
Estos factores provocan un aumento de la actividad metabólica en la médula ósea que se puede observar mediante técnicas de imagen avanzada, como es la tecnología híbrida de tomografía por emisión de positrones (PET) y resonancia magnética (RM), disponible en el CNIC. “El aumento de actividad en la médula ósea —señala la cardióloga del CNIC Ana Devesa, primera firmante del artículo— desencadena un proceso inflamatorio que activa el proceso de aterosclerosis, desde sus fases más incipientes hasta la aparición de la placa establecida”.
eBiomedicine
Descubren un nuevo método para la detección precoz de la aterosclerosis subclínica

Un estudio realizado en el CNIC y el Instituto de Investigación Sanitaria-Fundación Jiménez Díaz ha identificado proteínas circulantes en plasma sanguíneo que permiten detectar aterosclerosis en personas sanas sin síntomas, incluso en aquellas que no tienen ningún factor de riesgo de desarrollar enfermedad cardiovascular.
La prevención temprana es el mejor enfoque para combatir esta enfermedad, que tiene una fase subclínica prolongada, pero que solo se suele diagnosticar en una etapa más avanzada o cuando tiene lugar un evento cardiovascular.
Las técnicas de imagen cardiovascular no están disponibles universalmente y existe una variación sustancial en la cantidad de aterosclerosis entre individuos pertenecientes a la misma categoría de riesgo; por ello, existe mucho interés en desarrollar otras técnicas rápidas y no invasivas para detectar la carga aterosclerótica.
La identificación de biomarcadores plasmáticos estrechamente asociados con la aterosclerosis subclínica, como muestra este nuevo trabajo publicado en eBioMedicine, podría superar esta limitación y mejorar la predicción del riesgo cardiovascular.
Los investigadores utilizaron una colección de más de 880 muestras de plasma sanguíneo de individuos pertenecientes al estudio PESA CNIC-Santander para llevar a cabo un análisis masivo utilizando técnicas proteómicas, con el objetivo de identificar biomarcadores circulantes que pudieran detectar aterosclerosis en su estado subclínico.
De entre los potenciales biomarcadores detectados, se seleccionó un panel de tres proteínas cuyo poder predictivo se validó posteriormente en una colección de 3.000 muestras de plasma de la cohorte ILERVAS, utilizando técnicas rápidas y asequibles, con la colaboración de la empresa The Binding Site y el Hospital Quirónsalud Madrid (Pozuelo de Alarcón).
“El grupo del CNIC tiene amplia experiencia en la aplicación de técnicas proteómicas de última generación para el análisis masivo de muestras de pacientes con distintas patologías cardiovasculares, y llevamos varios años colaborando con nuestros colegas de la IIS-FJD en la búsqueda y validación de biomarcadores cardiovasculares”, detalló Jesús Vázquez, investigador principal del CIBERCV, jefe del laboratorio de Proteómica Cardiovascular del CNIC y coordinador del estudio.
A pesar de que hay numerosos trabajos que han demostrado que la detección de calcificación coronaria o placas carotídeas mediante el uso de herramientas de imagen no invasivas mejora la predicción y reclasificación del riesgo en comparación con los factores de riesgo convencionales, estas técnicas de imagen tienen ciertas limitaciones.
Como señala Vázquez, “las técnicas de imagen permiten detectar eficazmente la presencia de aterosclerosis, pero el análisis es costoso y requiere un personal altamente cualificado y un equipamiento que en algunas regiones y países no está disponible”.
Este es el estudio más grande realizado hasta la fecha que explora la asociación entre los niveles de proteínas plasmáticas y la aterosclerosis subclínica con el uso de proteómica cuantitativa no sesgada de alto rendimiento. El trabajo demuestra el potencial de la proteómica basada en espectrometría de masas para descubrir nuevos biomarcadores de enfermedades humanas.
Este estudio ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades de España a través del Instituto Carlos III de Salud-Fondo de Investigación Sanitaria, CIBERCV y CIBERDEM, Fundació La Marató de TV3 y Fundación “la Caixa”. El estudio PESA está cofinanciado a partes iguales por el Centro Nacional de Investigaciones Cardiovasculares (CNIC) y el Banco Santander. El estudio ILERVAS ha sido financiado por la Diputación de Lleida.
JACC
La ecografía vascular en 3D matrix identifica con precisión el daño cardiovascular en personas sanas
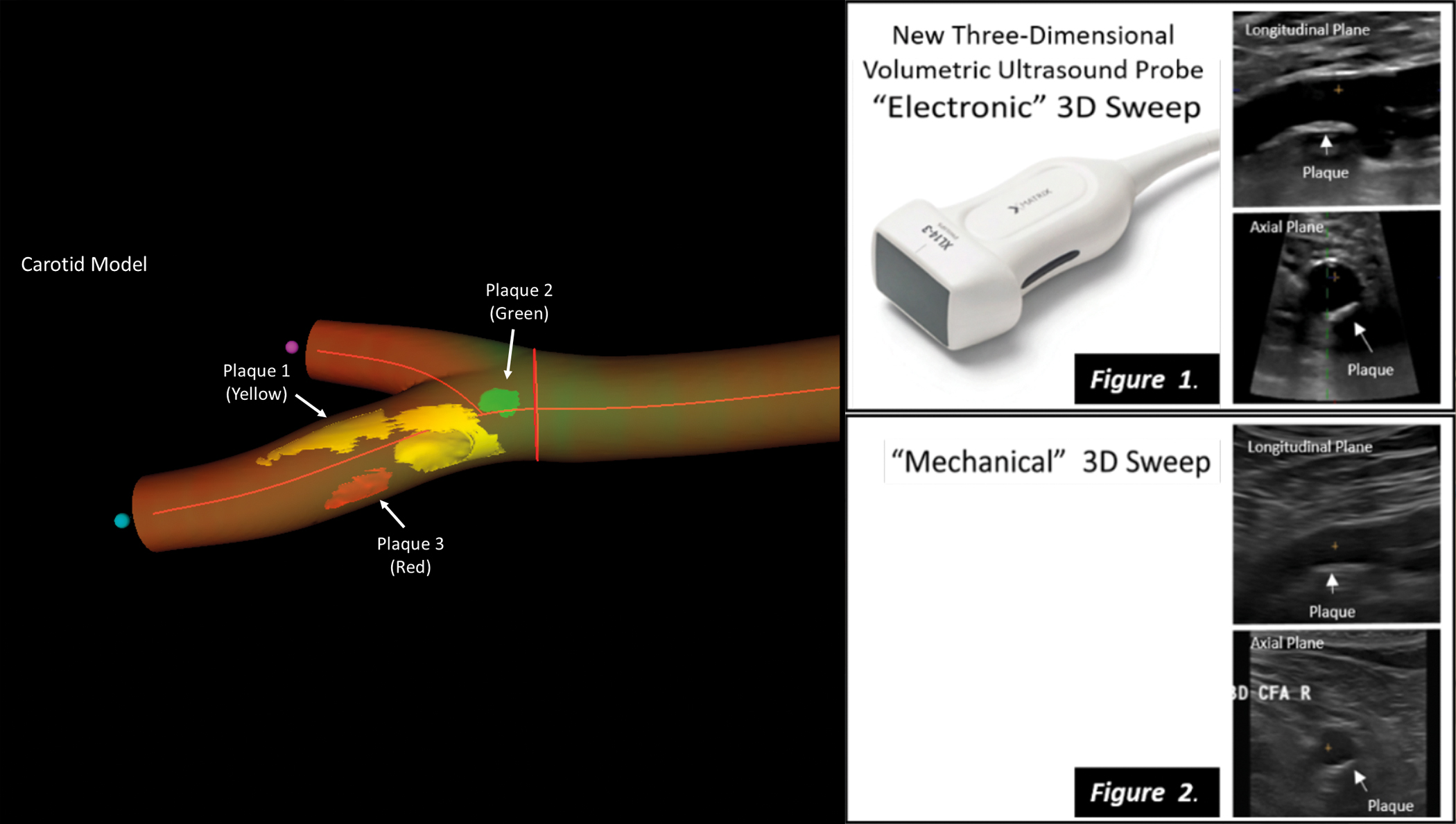
La ecografía vascular en 3D real puede convertirse en una herramienta clave para la prevención de la enfermedad cardiovascular en personas aparentemente sanas en combinación con los parámetros de riesgo tradicionales, como el colesterol, la hipertensión, etc. Según los resultados de un estudio que se publicó en JACC: Cardiovascular Imaging, la ecografía vascular en 3D real ha demostrado ser fiable, precisa y más ágil en la evaluación del volumen de placa carotídea y femoral.
Los primeros resultados de este método de imagen se validaron e implementaron en un estudio de cerca de 200 individuos sanos con un riesgo cardiovascular intermedio en el proyecto Athero Brain: Head-to-Heart, dirigido por el Dr. Valentín Fuster, Director General del CNIC. Actualmente, la tecnología se está utilizando en el estudio PESA-CNIC-Santander.
Los investigadores del CNIC han colaborado con su socio tecnológico, Philips Ultrasound y Philips Research Paris-Medisys, para desarrollar una nueva sonda y un nuevo software en 3D real que facilita la exploración de las arterias carótidas y femorales y agiliza la cuantificación del volumen de aterosclerosis.
La nueva sonda vascular 3D validada en el CNIC incorpora la última tecnología 3D matrix en la que se han basado las más avanzadas tecnologías de ecocardiografía 3D. Explica el Dr. Borja Ibáñez, director de Investigación Clínica del CNIC, que la tecnología permite el estudio simultáneo 2D y 3D con todas las funcionalidades posibles de los ultrasonidos (doppler color, power-doppler y ecografía con contraste) de forma sencilla, siendo fácil de incorporar en la práctica diaria de técnicos y médicos que ya usaban ecografía antes. “El software de análisis que integra la ecografía vascular en 3D es un software con procesamiento en 3D real”, afirma.
En el estudio, además de evidenciar su precisión, se demuestra que este método reduce a la mitad el tiempo necesario para obtener toda la información de la carga de placa carotídea y femoral, datos que el médico precisa para el manejo correcto del paciente.
Lo más destacado para el paciente es que el software le permite visualizar sus propias arterias como un molde virtual 3D y así aprecia más fácilmente el daño acumulado. “Cuando ven el estado de sus arterias, los pacientes adquieren una mayor conciencia de la necesidad de cambiar de hábitos de vida que si únicamente leen los números en una analítica”, asegura la primera firmante de este estudio, la Dra. Beatriz López Melgar. Con el desarrollo de esta tecnología, agrega la cardióloga, “ahora sí disponemos de una herramienta que podemos hacer sobre la marcha, en la misma consulta, acelerando la toma de decisiones, porque en prevención cardiovascular no hay que perder el tiempo”.
Este proyecto ha contado con la participación de investigadores del CIBER de Enfermedades Cardiovasculares (CIBERCV) y ha sido posible gracias a la financiación del Ministerio de Economía, Industria y Competitividad (MEIC) y del Fondo Europeo para el Desarrollo Regional.
NATURE
Completan el primer atlas celular de todo el cuerpo de un primate no humano
En un avance que podría conducir al progreso científico en el tratamiento de enfermedades humanas, un equipo de investigadores internacional liderado por Pura Muñoz-Cánoves (catedrática de la UPF y también profesora ICREA, CIBERNED y del Centro Nacional de Investigaciones Cardiovasculares - CNIC) ha publicado el primer atlas transcriptómico de células de todo el cuerpo de primates no humanos del mundo en la revista Nature.
Utilizando la plataforma de secuenciación de bibliotecas unicelulares DNBelab C4, desarrollada de forma independiente por el BGI-Research, los investigadores completaron el transcriptoma unicelular de 45 tejidos y órganos de monos macacos de cola larga (cynomolgus), obteniendo un total de 1,14 millones de datos unicelulares e identificando 113 tipos de células principales.
Los primates no humanos, como los macacos, son las especies más cercanas a los humanos en el árbol evolutivo. Al cartografiar el transcriptoma del macaco a nivel unicelular, los científicos disponen ahora de una base de datos, o biblioteca unicelular, que puede utilizarse para desarrollar métodos de diagnóstico y tratamiento de enfermedades, evaluar la eficacia de los fármacos clínicos y analizar la evolución celular entre especies y las funciones cognitivas avanzadas del cerebro.
El mapeo de células individuales ha permitido al equipo identificar los tipos de células que pueden contribuir a las enfermedades humanas o hacer que los individuos sean más susceptibles a la enfermedad. Por ejemplo, en COVID-19, la mayor manifestación es la neumonía porque el SARS-CoV-2 infecta un pequeño grupo de células en el pulmón. Sin embargo, el mapeo unicelular del macaco también identificó ciertas células en otros tejidos que pueden infectarse en los primates. Esto puede ayudar a los médicos a entender dónde buscar signos de COVID-19.
El mapeo unicelular también puede ayudar a identificar qué células metabolizan las calorías de la grasa, lo que permite a los investigadores comprender los factores subyacentes que contribuyen a la obesidad. Del mismo modo, este proceso podría ayudar a identificar qué células regulan los circuitos neuronales en el cerebro, lo que conduciría a posibles tratamientos para enfermedades neurológicas.
“Este trabajo será una referencia fundamental para este ámbito de investigación y será muy útil para futuros estudios de primates, incluidos los humanos, ya que ayudará a entender la naturaleza de nuestra propia especie”, señaló Pura Muñoz-Cánoves.
“Al comprender los tipos de células y sus características, los científicos podrán predecir el impacto de los tratamientos de enfermedades en estructuras celulares específicas y, por lo tanto, desarrollar enfoques más específicos para enfermedades genéticas monogénicas o complejas”, aseguró el Dr. Xu Xun, coautor del artículo y director de BGI-Research.
Para Pura Muñoz-Cánoves y Joan Isern (investigador senior del CNIC que también ha participado en el estudio), “en lo que se refiere al músculo esquelético, el tejido de interés en nuestro laboratorio, la RNA-seq de núcleo único ofrece la posibilidad de estudiar poblaciones celulares que no pueden ser caracterizadas por el análisis convencional de RNA-seq de célula única, como los mionúcleos de las fibras musculares esqueléticas multinucleadas”. Y añaden que, “por lo tanto, este atlas será valioso para comprender los tejidos que no han sido perfilados en absoluto a nivel de célula/núcleo único en humanos o que carecen de suficiente número de células, estableciendo comparaciones adaptativas entre especies y prediciendo la susceptibilidad a las enfermedades”.
El estudio Cell transcriptomic atlas of the non-human primate Macaca fascicularis ha contado con la participación de investigadores de China, Alemania, Italia, Singapur, Suecia y el Reino Unido, además de España.
REDOX BIOLOGY
Describen un nuevo mecanismo de modulación de la elasticidad del músculo cardiaco

Investigadores del CNIC describieron un nuevo mecanismo de modulación mecánica del corazón, basado en oxidaciones de la proteína titina, principal responsable de la elasticidad pasiva del miocardio.
Titina es la proteína más grande presente en el ser humano y es un componente clave para el funcionamiento de nuestros músculos en general, y del corazón en particular. Simplificando mucho, “podemos describirla como un muelle molecular, que permite que las células musculares se estiren y se contraigan”, explicó el Dr. Jorge Alegre Cebollada, líder del laboratorio de Mecánica Molecular del Sistema Cardiovascular del CNIC.
El trabajo, que se publicó en Redox Biology, parte de observaciones previas que demostraban que oxidaciones en el aminoácido cisteína modulaban la mecánica de titina in vitro. “Nos preguntamos si dichas oxidaciones podrían estar también presentes in vivo, y explicar, por ejemplo, cómo la mecánica del corazón se adapta a diferentes situaciones o se ve afectada en ciertas patologías que alteran el equilibrio oxidativo”, aseguró el Dr. Alegre Cebollada.
“En primer lugar, nos dimos cuenta de que existían un conjunto de cisteínas en titina que estaban extraordinariamente conservadas a lo largo de la evolución, lo que habla de su importancia para la función de la proteína”, detalló el Dr. Elías Herrero Galán, codirector del estudio. Estos mecanismos podrían explicar las alteraciones que sufre el corazón en patologías que afectan a su estado oxidativo, como por ejemplo el infarto de miocardio
Los resultados de la investigación mostraron que esas cisteínas eran justamente las que mostraban una mayor relevancia para la mecánica de la proteína in vitro. Los experimentos demuestran que son objeto de oxidaciones en condiciones fisiológicas, tanto en el corazón de ratón como en el de los humanos.
Los autores concluyen que este mecanismo también podría explicar las alteraciones que sufre el corazón en numerosas patologías que afectan a su estado oxidativo, como por ejemplo el infarto de miocardio.
El estudio ha contado con la financiación del Ministerio de Ciencia e Innovación, la Comunidad Autónoma de Madrid y la Fundación “la Caixa”. Además, ha recibido apoyo de la Red Europea de Investigación en Enfermedades Cardiovasculares mediante la subvención del proyecto MINOTAUR.
Nature Cardiovascular Research
Atlas dinámico en 3D de la formación del corazón embrionario

Investigadores del CNIC crearon un atlas 3D del proceso de formación del corazón en su fase embrionaria, a partir de una colecció n de muestras de ratón. El atlas 3D ha permitido identificar el inicio de la asimetría izquierda-derecha del corazón, según se detalla en un estudio publicado en Nature Cardiovascular Research, que aporta información relevante sobre el desarrollo de las malformaciones cardiacas.
Durante la cardiogénesis temprana no hay dos corazones embrionarios que se parezcan mucho, hasta el punto de ser tan diferentes que es difícil decidir cuál se encuentra en una etapa de desarrollo más avanzada. Sin embargo, aseguró el Dr. Miguel Torres, jefe del grupo de Control Genético del Desarrollo y Regeneración de Órganos del CNIC y director del estudio, “las primeras morfologías aparentemente divergentes convergen más tarde para producir un corazón típico de recién nacido”.
El desafío es capturar la evolución promedio de la geometría del tejido cardiaco a partir de su amplia gama de variabilidad natural y poder discriminar entre variaciones morfológicas fisiológicas y anormales de entre una muestra lo suficientemente grande. “Solo entonces seríamos capaces de comprender las propiedades de la morfogénesis fisiológica e identificar cuándo y cómo ocurren las anomalías”, explicó el Dr. Torres.
Para superar las limitaciones a la hora de obtener imágenes en vivo, el equipo del CNIC adquirió imágenes de alta resolución de una colección amplia de corazones embrionarios de ratón recogidos durante etapas clave de su desarrollo y con una alta densidad temporal.
“Nos dimos cuenta de que la morfogénesis del corazón no podía aislarse de la de los tejidos circundantes, ya que la formación del tubo cardiaco se asemeja a un pliegue geológico producido en una capa continua del mesodermo —capa celular que constituye el embrión— de la cavidad pericárdica”, explicó el Dr. Torres. Por lo tanto, añade el primer autor del estudio, Isaac Esteban, “capturamos todos los tejidos de la cavidad pericárdica y el endodermo del intestino anterior subyacente”.
Posteriormente, los investigadores transformaron las imágenes en versiones digitales y, gracias a un sistema de estadiaje morfométrico, las ordenaron temporalmente, ya que el momento de la obtención de embriones no se corresponde necesariamente con el tiempo de desarrollo morfológico real.
Los científicos del CNIC han empleado un enfoque desarrollado recientemente: el mapeo entre superficies, que genera mapas de puntos correspondientes entre formas similares con una densidad de puntos suficiente para reconstruir toda la superficie de los objetos. Así crearon un atlas temporal en 3D que muestra la trayectoria de la formación del tubo cardiaco y la variabilidad morfológica local en cada etapa.
La información obtenida muestra que las regiones habitualmente involucradas en malformaciones cardiacas coincidían con regiones de alta heterogeneidad morfológica y/o alta variabilidad en el tiempo de desarrollo. Esta observación sugiere que la variabilidad morfológica puede ser la base de la alta incidencia natural de malformaciones congénitas cardiacas, que afectan al 1% de los nacidos vivos.
La principal limitación del estudio es el uso de imágenes fijas para reconstruir un proceso dinámico, lo cual no permite analizar las bases celulares de la deformación de los tejidos. El atlas generado, sin embargo, será una base imprescindible para contribuir a ese conocimiento y los científicos están ya trabajando en incorporar datos celulares a este nuevo atlas dinámico del desarrollo del corazón.
eLife
Revelan cómo la distrofia muscular de Duchenne altera el ritmo cardiaco y causa arritmias
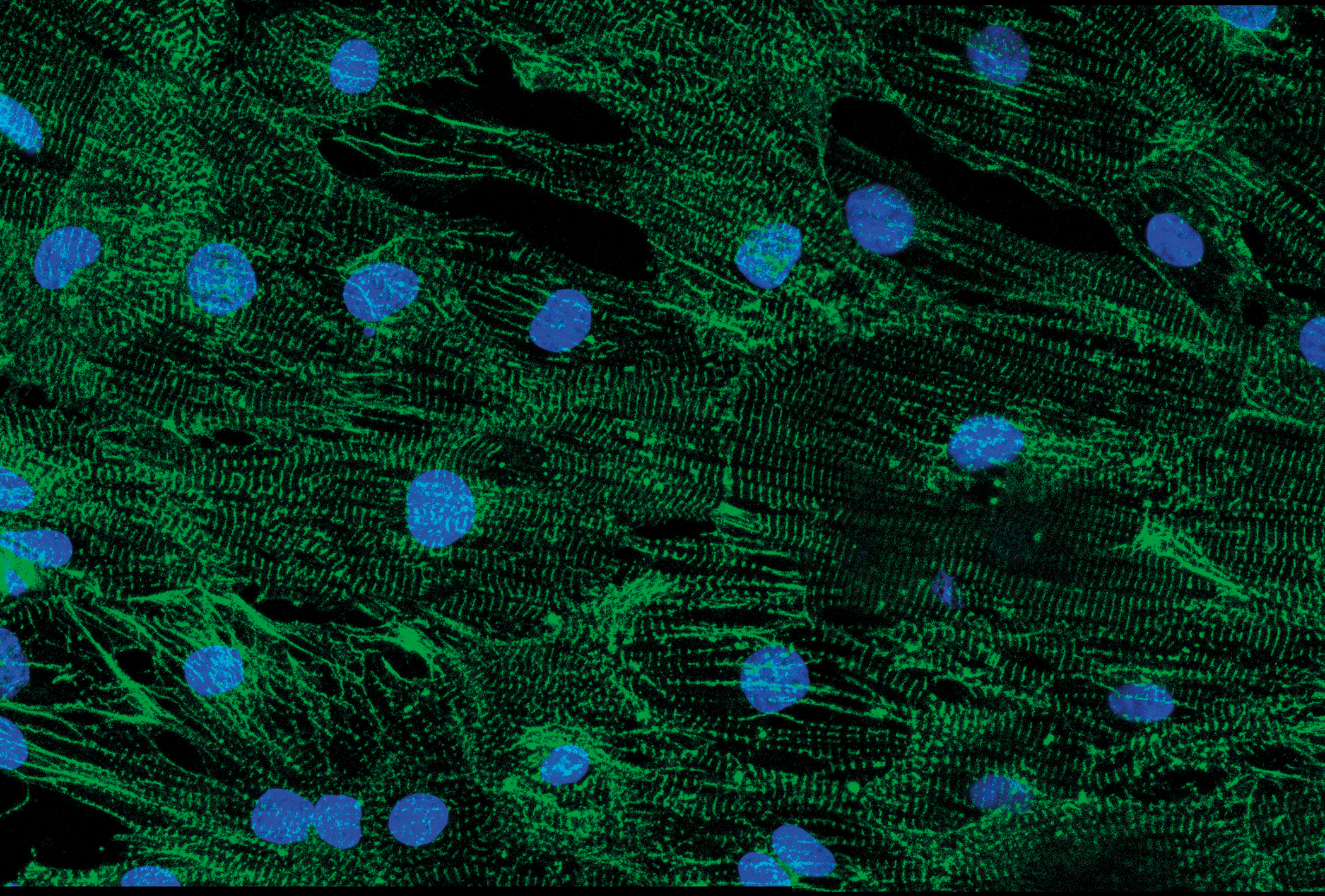
Anomalías en las proteínas encargadas de transmitir las señales eléctricas en el corazón son las responsables de causar ritmos cardiacos anormales o arritmias en los pacientes con distrofia muscular de Duchenne (DMD), según un estudio publicado en eLife realizado en el CNIC.
Los resultados ayudan a explicar por qué hasta el 60% de los pacientes con DMD presenta anomalías en su ritmo cardiaco. También pueden ser de ayuda para un potencial tratamiento para los problemas cardiacos de las personas con DMD. La distrofia muscular de Duchenne es una enfermedad hereditaria progresiva y extremadamente letal del músculo esquelético causada por mutaciones en la distrofina.
“Nadie sabe por qué los pacientes con distrofia muscular de Duchenne desarrollan anomalías en el ritmo cardiaco”, explicó el primer autor, Eric Jiménez-Vázquez, científico investigador en el Centro de Investigación en Arritmias en la Universidad de Michigan en Ann Arbor (EE.UU).
El estudio es fruto de la colaboración de médicos y científicos de cuatro laboratorios diferentes en tres países distintos: la Universidad de Michigan, en EE.UU., el CNIC, en España, y el Centro Médico Sheba y el Instituto Technion, ambos en Israel.
Los investigadores recogieron biopsias de la piel de tres personas con DMD y dos voluntarios sanos sin DMD. Dos participantes con la enfermedad eran hombres que heredaron una copia anormal del gen de la distrofina y la otra era una mujer con una copia mutante y una copia normal del gen. Para determinar por qué los pacientes desarrollaron arritmias, convirtieron en el laboratorio las células de la biopsia en células madre y, posteriormente, las programaron para que se convirtieran en células del músculo cardiaco.
Cuando se analizó la actividad eléctrica en las células del corazón recién formadas, encontraron que las células de personas con DMD tenían señales eléctricas más lentas, generaban arritmias y eran menos capaces de contraerse que las células de las personas sin DMD. Además, tenían menos iones de potasio y sodio en sus membranas celulares, ambos esenciales para el correcto funcionamiento eléctrico de señalización en el corazón. También encontraron que las células del músculo cardiaco cultivadas de los hombres con DMD tenían menos canales de iones de sodio y potasio —que controlan el flujo de sodio y potasio— que las personas sin la enfermedad.
Sin embargo, los investigadores vieron que agregar una proteína asociada esencial de los canales de sodio y potasio llamada sintrofina- α1- a las células de uno de los varones con DMD corrigió la actividad eléctrica en las células y previno los ritmos anómalos.
Los descubrimientos pueden ayudar a explicar por qué tanto los hombres como las mujeres con DMD pueden sufrir alteraciones del ritmo cardiaco. En la distrofia muscular de Duchenne, los hombres se ven afectados con mayor frecuencia, pero las mujeres pueden ser portadoras porque el gen de la distrofina se encuentra en el cromosoma X.
Debido a que los hombres tienen un cromosoma X y uno Y, si heredan la mutación DMD del cromosoma X de su madre no tienen forma alguna de producir proteína distrofina activa. Así, tienen una alta probabilidad de desarrollar la enfermedad.
Mientras que las mujeres, que tienen dos cromosomas X, no suelen tener síntomas de la enfermedad porque pueden producir distrofina a partir de su cromosoma X. Sin embargo, el patrón de distribución del cromosoma dañado en las células del corazón es aleatorio y puede determinar la gravedad de sus síntomas. Este patrón inconsistente puede también explicar por qué las mujeres con DMD, en ocasiones, son tan propensas a los ritmos cardiacos como los hombres.
“Nuestro estudio ayuda a explicar por qué las personas con DMD desarrollan anomalías graves del ritmo cardiaco y puede ayudar a los científicos a desarrollar nuevos tratamientos para esta complicación potencialmente mortal”, añadió el autor principal, José Jalife, investigador del CNIC y profesor emérito de Medicina y Fisiología Molecular e Integrativa de la Universidad de Michigan.
El estudio ha contado con el apoyo de las siguientes entidades: Fundación “la Caixa”; Fundació La Marató de TV3: Ayudas a la investigación en enfermedades raras 2020; Instituto de Salud Carlos III/FEDER/FSE - Horizonte 2020 - Programa Marco de Investigación e Innovación; Instituto de Salud Carlos III (ISCIII); y Ministerio de Ciencia e Innovación (MCIN).
Hepatology
Descubren que las células inmunitarias regulan la temperatura corporal a través del hígado
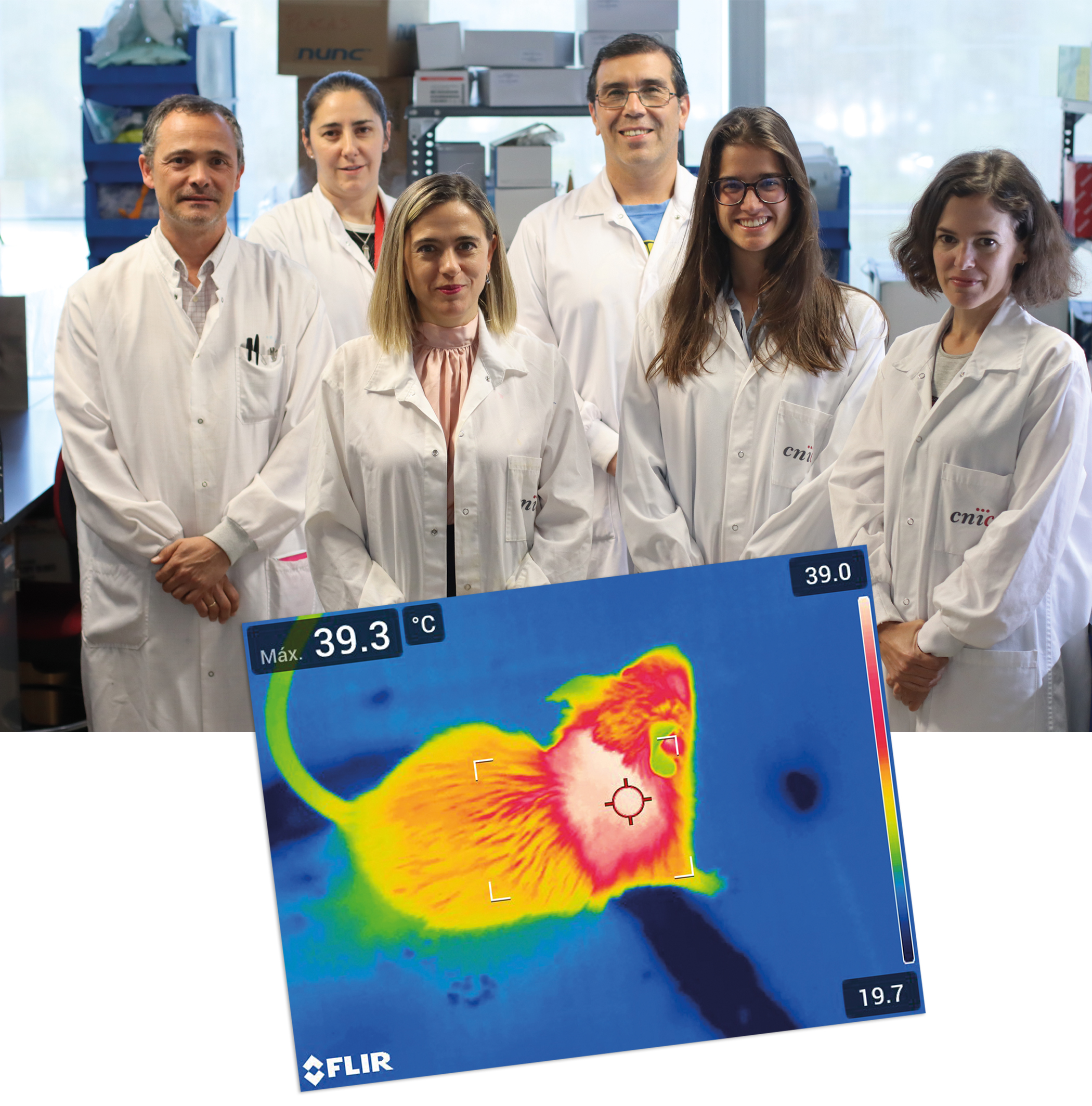
Un estudio publicado en Hepatology resalta la importancia de la termogénesis en la obesidad, ya que su activación permite quemar energía y, por tanto, favorece la pérdida de peso y mejora la diabetes. Realizado por investigadoras del CNIC, el estudio ha descubierto una compleja red de conexiones entre tejidos mediante la cual el hígado regula la temperatura corporal. En concreto, han demostrado que las células inmunitarias presentes en el hígado, cuando secretan una molécula llamada IL-12, disminuyen la producción de calor generada por la grasa parda.
En este estudio se desvela que una de esas moléculas, la proteína IL-12, bloquea la producción de la proteína FGF21 en el hígado, lo que conlleva una reducción de la producción de calor en la grasa parda. Además, se ha descubierto por primera vez cómo la activación de la proteína p38 en las células inmunes controla la producción de IL-12 y, en consecuencia, la función endocrina del hígado, afectando al metabolismo de todo el organismo. “Hemos observado que, al eliminar la vía del estrés de los macrófagos, estos presentan una peor adaptación a la dieta grasa, aumentando la producción de IL-12, lo que disminuye la producción de calor”, indicó María Crespo, primera firmante del artículo.
En la investigación se explica que la IL-12 secretada por los macrófagos infiltrados en el hígado controla la producción de FGF21, que a su vez modula la termogénesis de la grasa parda, controlando así el gasto energético del organismo. Esta es la primera vez que se demuestra que los macrófagos de otro órgano también pueden regularla a través de un mecanismo completamente distinto. Este trabajo pone de manifiesto la importancia de la termogénesis en la obesidad, ya que su activación permite quemar energía y, por tanto, favorece la pérdida de peso y mejora la diabetes. En este sentido, las investigadoras señalan que, como ya hay disponibles fármacos que reducen los niveles de IL-12, podrían ser utilizados en pacientes obesos o con síndrome metabólico.
Además del grupo de la Dra. Sabio en el CNIC, en este trabajo también han participado investigadores del grupo CIBER del área de Fisiopatología de la Obesidad y Nutrición (CIBERobn), investigadores de la Universidad Rey Juan Carlos, así como investigadores del Hospital Universitario de Salamanca.
Asimismo, la investigación ha recibido apoyo de las siguientes entidades financiadoras: Asociación Española contra el Cáncer; EFSD; Lilly European Diabetes Research Programme; Ministerio de Ciencia, Innovación y Universidades; Comunidad de Madrid; Fundación BBVA; y European Union 7th Framework Programme.
Science Advances
Descubren que las células inmunitarias regulan la temperatura corporal a través del hígado
Los genes que hacen que una célula sea pluripotente y que tenga la capacidad de convertirse en cualquier otro tipo de célula durante la etapa embrionaria también influyen en el proceso por el que las células eligen cuál será su identidad celular y la de sus descendientes. Lo demuestra una estudio del CNIC, en colaboración con el Centro de Biología Molecular Severo Ochoa, centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad Autónoma de Madrid (UAM), cuyos resultados han sido publicados en Science Advances.
Tras la fecundación se genera el cigoto, una única célula a partir de la cual se va a desarrollar un organismo completo. En las primeras divisiones las células son equivalentes, tienen una gran capacidad de proliferar y una plasticidad que les permitirá desarrollar células tan diferentes como una neurona o un hepatocito. Sin embargo, esa potencia se va perdiendo progresivamente a lo largo del desarrollo embrionario, ya que las células van tomando decisiones de linaje y diferenciándose.
“Hasta ahora se pensaba que esos genes solo hacían a la célula pluripotente, pero hemos visto que también influyen en el siguiente proceso, el de diferenciación. Tras la implantación en el útero, el embrión realiza un proceso que se llama gastrulación, en el cual las células eligen su destino dentro del cuerpo y en este momento deja de existir la pluripotencia como tal. Sin embargo, la expresión de los factores de pluripotencia continúa un poco más en el tiempo y nuestro objetivo ha sido comprender por qué estos factores continúan expresándose y cuál es su función más allá de la pluripotencia”, explica el investigador Miguel Manzanares.
La capacidad de generar cualquier tipo de célula se mantiene en el embrión gracias a la acción de los llamados factores de pluripotencia (OCT4, NANOG y SOX2, entre otros), que solo se expresan en las primeras fases del desarrollo, mientras que en un organismo adulto están apagados.
La presente investigación se ha centrado principalmente en OCT4, que es uno de los cuatro factores que en 2006 fueron sobreexpresados por Shinya Yamanaka para conseguir reprogramar fibroblastos adultos (células que contribuyen a la formación del tejido) y convertirlos en células madre inducidas, trabajo por el que le concedieron el Premio Nobel de Fisiología y Medicina en 2012.
Para estudiar en detalle este proceso, el equipo de investigación ha caracterizado tanto in vivo como in vitro cómo influye el factor OCT4 en la regulación de los genes Hox, que son los encargados de dar identidad a las células del eje anteroposterior del embrión.
“Hay numerosos trabajos acerca de la pluripotencia, sin embargo, se conoce mucho menos cómo se desensambla esta red para permitir la determinación de un linaje celular específico. Comprender la pluripotencia es la piedra Rosetta para desentrañar procesos tan importantes y complejos como la regeneración de tejidos, el rejuvenecimiento o el cáncer”, concluye Manzanares.
EJHF
La combinación de datos genéticos y de imagen mejora el tratamiento de la miocardiopatía dilatada

Combinar la información genética de una persona con los datos que se obtienen a través de una resonancia magnética se muestra como el mejor sistema para predecir el pronóstico de los pacientes con la causa más frecuente de insuficiencia cardiaca, la miocardiopatía dilatada.
Lo demuestra un estudio colaborativo español que se publica en la revista European Journal of Heart Failure coordinado por el Dr. Pablo García-Pavía, investigador del CNIC, cardiólogo del Hospital Puerta de Hierro Majadahonda (Madrid) y del CIBER de Enfermedades Cardiovasculares (CIBERCV). Se trata del trabajo más grande realizado en el mundo con pacientes con miocardiopatía dilatada estudiados genéticamente y sometidos a una resonancia magnética en los que se ha seguido su evolución.
La miocardiopatía dilatada es la causa más frecuente de insuficiencia cardiaca en jóvenes y la principal causa de trasplante cardiaco en todo el mundo. Puede afectar a hasta 1 de cada 250 personas en la población general, y se caracteriza por el agrandamiento del corazón y la disminución de su capacidad para el bombeo de sangre. Asimismo, los pacientes que padecen esta enfermedad sufren con frecuencia arritmias y muerte súbita.
La investigación recogió los datos de 600 pacientes estudiados genéticamente en 20 hospitales españoles entre 2015 y 2020. Los investigadores comprobaron que la combinación de los datos genéticos y la presencia de fibrosis en la resonancia permitía identificar de forma más precisa los pacientes que iban a desarrollar arritmias malignas o padecer complicaciones graves en su evolución. Actualmente, no se dispone de buenos indicadores que sirvan para determinar cuál va a ser el pronóstico de los pacientes con miocardiopatía dilatada.
Lo que ahora demuestra la investigación es que clasificar a los pacientes según las características genéticas y la presencia de fibrosis en la resonancia magnética es un sistema “muy superior a hacerlo según el grado de debilidad del corazón, que es lo que hasta ahora se empleaba, ya que hay pacientes con un corazón con poca debilidad que presentan complicaciones y otros con un grado de debilidad alto que se mantienen bien y no presentan problemas a largo plazo”, detalló el Dr. García-Pavía.
En concreto, los investigadores han encontrado que, si el paciente no tiene una alteración genética y no muestra fibrosis, su pronóstico es muy bueno y es poco probable que vaya a experimentar una muerte súbita independientemente de la capacidad de bombeo de sangre del corazón.
Este trabajo, concluyen los autores, abre la puerta a realizar un abordaje diferente al actual para dar el tratamiento más adecuado a cada paciente, avanzando en la aplicación de la medicina personalizada o de precisión en la cardiología.
En el estudio han participado: Hospital Universitario Puerta de Hierro, IDIPHISA; CIBER Cardiovascular; Hospital General Universitario Gregorio Marañón; Instituto de Investigación Biomédica de Salamanca (IBSAL) - Complejo Asistencial Universitario de Salamanca; Universidad de Salamanca; Hospital Universitario Virgen de la Arrixaca de Murcia; Hospital Universitari Vall d’Hebron, Vall d’Hebron Institut de Recerca (VHIR), Universitat Autònoma de Barcelona; Complejo Hospitalario de Navarra; Instituto de Investigación Biomédica de A Coruña (INIBIC), Complexo Hospitalario Universitario de A Coruña; Universidad de A Coruña; Complejo Hospitalario Universitario de Cáceres; Hospital Universitario Virgen de la Victoria IBIMA, Málaga; Instituto de Ciencias del Corazón (ICICOR); Hospital Clínico Universitario de Valladolid; Hospital General Universitario de Alicante, Instituto de Salud e Investigación Biomédica; Hospital Universitario 12 de Octubre, Instituto de Investigación i+12; Hospital Clínico, IDIBAPS, Universitat de Barcelona; Instituto de Investigación Sanitaria de Santiago; Complexo Hospitalario Universitario de Santiago; Hospital Universitario Virgen de las Nieves; Hospital Universitario Son Llàtzer & IdISBa; Hospital Universitario Virgen del Rocío; Hospital Univesitari Dr. Josep Trueta; Instituto del Corazón & Hospital Universitario Germans Trias; y Universidad Francisco de Vitoria (UFV).
Este trabajo ha recibido becas del Instituto de Salud Carlos III, cofinanciado por Fondo de Desarrollo Regional/Fondo Social Europeo “Una forma de hacer Europa”/”Invertir en tu futuro”.
European Heart Journal
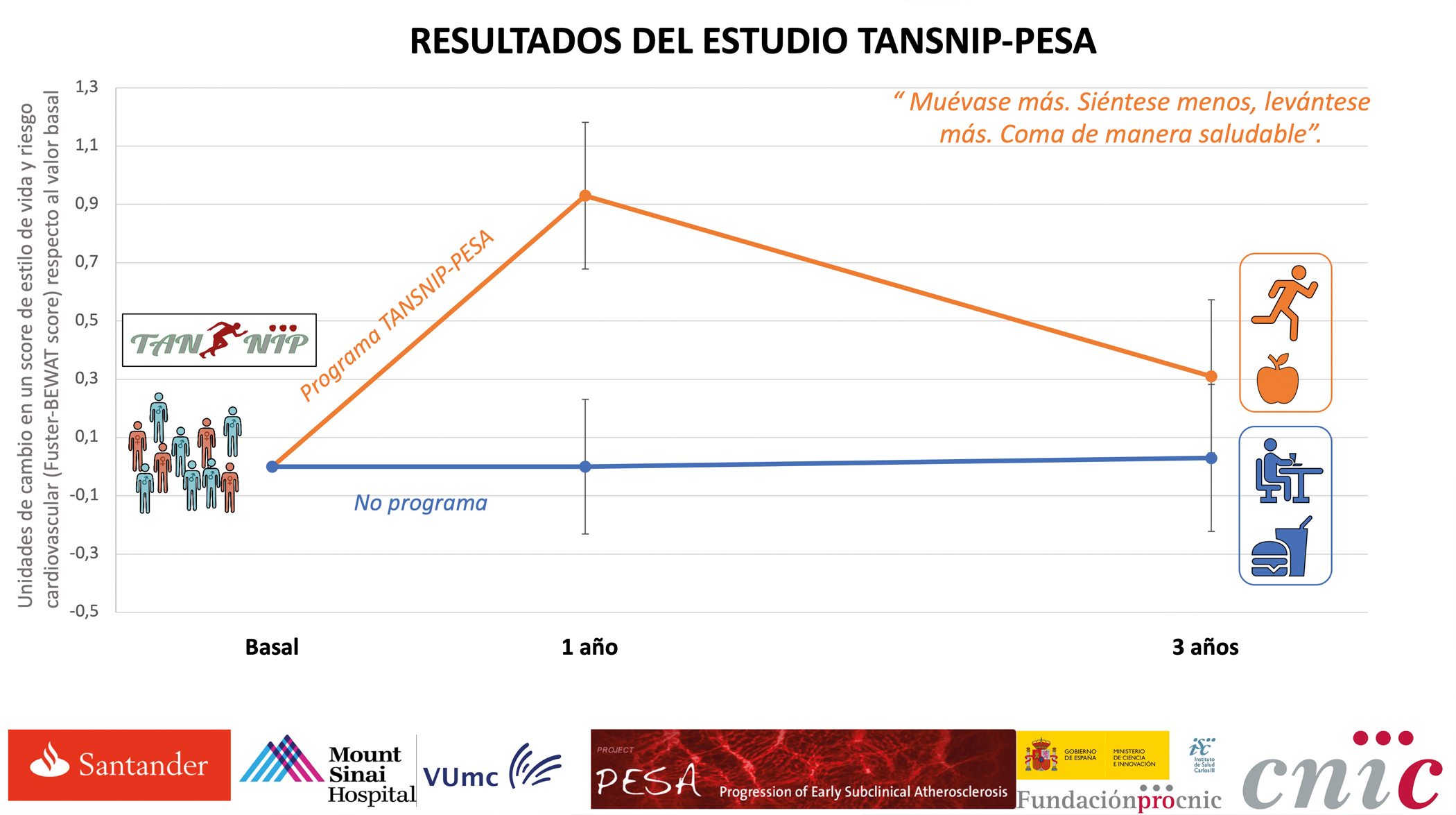
“Un cambio al día son 365 cambios al año”
Una gran parte de las enfermedades cardiovasculares pueden prevenirse si se actúa sobre los factores de riesgo. Pequeños cambios saludables en nuestro comportamiento, sostenidos en el tiempo, pueden ayudarnos a preservar nuestra salud cardiovascular. Lo ha demostrado un estudio realizado en el CNIC que se publicó en European Heart Journal. Además, los resultados muestran que el lugar de trabajo es un sitio idóneo para fomentar un estilo de vida cardiosaludable y conseguir importantes beneficios para la salud de las personas.
Hace años, el Dr. Valentín Fuster, Director General del CNIC, inició el proyecto TANSNIP, una iniciativa internacional que cuenta con la participación de distintos centros en EE.UU. (Icahn School of Medicine del Hospital Mount Sinai de Nueva York y el estudio Framingham) y Europa (CNIC y University Medical Center en Ámsterdam). TANSNIP es un proyecto dirigido a desarrollar herramientas para mejorar el estilo de vida basadas en la detección mediante técnicas de imagen de la presencia de aterosclerosis en sus estadios iniciales, antes de que se produzcan los síntomas como el infarto de corazón o el infarto cerebral.
En 2015 comenzó uno de los estudios de este gran proyecto que pretendía llevar a cabo una intervención dirigida a promover un estilo de vida cardiosaludable en 1.000 individuos de la cohorte PESA-CNIC-Santander en Madrid.
“Después de meses de trabajo con nuestros colaboradores de Ámsterdam UMC y con los servicios médicos del Banco Santander, diseñamos un programa para las personas que forman parte de la cohorte PESA-CNIC-Santander”, explicó la Dra. Inés García-Lunar, cardióloga del CNIC y primera autora de este trabajo.
Esta intervención consiste en un programa de 12 sesiones motivacionales distribuidas a lo largo de 3 años en las que una psicóloga experta facilitaba a los participantes las herramientas para introducir los cambios cardiosaludables en su estilo de vida. Además, se les entregaba una pulsera de actividad física para registrar el número de pasos al día, y una mesa que permite alternar el tiempo trabajando sentado y de pie para disminuir el sedentarismo durante las horas de trabajo.
“Incluimos a más de 1.000 participantes del estudio PESA-CNIC-Santander, que fueron asignados de forma aleatoria a realizar la intervención durante las horas de trabajo en el Banco Santander o no”, indicó el Dr. Borja Ibáñez, director científico del CNIC y cardiólogo del Hospital Universitario Fundación Jiménez Díaz.
Un resultado muy importante es que el efecto de la intervención va disminuyendo a lo largo del tiempo, lo que nos hace pensar que este tipo de programas deben tener recuerdos frecuentes para conseguir cambios sostenidos que se mantengan a largo plazo
“Encontramos que los individuos que habían seguido la intervención mejoraron su nivel de actividad física y su dieta, redujeron el sedentarismo y, como consecuencia, su tensión arterial y su colesterol también disminuyeron”, explicó el Dr. José María Castellano, cardiólogo del CNIC y director científico de la Fundación de Investigación de HM Hospitales.
“Los resultados del presente estudio lanzan un mensaje optimista: un cambio a un estilo de vida más cardiosaludable es posible, también en la edad adulta, pero necesita reintervenciones posteriores”, señaló el Dr. Valentín Fuster, investigador principal del proyecto.
El estudio ha recibido financiación de la Fundación CNIC Carlos III a través de una Beca de Estudios Iniciados por Investigadores en la Escuela de Medicina Icahn de AstraZeneca. El estudio PESA está cofinanciado por el CNIC y Banco Santander. El estudio también ha recibido financiación del Instituto de Salud Carlos III (ISCIII) y el Fondo Europeo de Desarrollo Regional (FEDER).

















