Descubren cómo las células se optimizan y regulan molecularmente para elegir alimentarse de azúcares o grasas
Cell Metabolism - 23 de mayo de 2014
Científicos del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han descrito en la última edición de Cell Metabolism el proceso por el que las células optimizan y regulan molecularmente su capacidad de utilizar azúcares o grasas indistintamente para alimentarse. Como explica el principal autor de la investigación, José Antonio Enríquez, “la verdadera digestión de los alimentos se produce en todas y cada una de las células del cuerpo”. Mientras unas consumen preferentemente azúcares, otras se alimentan fundamentalmente de grasas y otras pueden cambiar de uno a otro nutriente, como se explica en el trabajo publicado en Cell Metabolism.
Para garantizar un uso eficiente de los alimentos que reciben, las células tienen sistemas que les permiten capturar y transportar a su interior aquellos nutrientes de los que disponen. Pero si tienen a su disposición varios tipos, pueden seleccionar aquellos que más les interesan y eliminar los productos no deseados.
En el interior de las células, los alimentos son distribuidos hacia las mitocondrias, la parte celular especializada donde los nutrientes se queman para extraer la energía que contienen. Tanto los azúcares (glucosa) como las grasas (ácidos grasos) terminan quemándose en las mitocondrias, pero estas deben ajustarse de manera diferente si su principal combustible proviene de los azúcares o de las grasas. “Este ajuste es equivalente al que necesitamos hacer en una caldera de gas, cuyos quemadores se adapta a la utilización de butano o gas ciudad”, subraya el Dr. Enríquez.
Así, añade el principal autor del trabajo, al cambiar la alimentación, al hacer ejercicio o después de un periodo de ayuno, la disponibilidad de alimentos suministrados a las células cambia y estas deben ser capaces de adaptarse. En situaciones concretas, como al activarse las células inmunitarias para defender al organismo de una infección, las células cambian de actividad aunque la disponibilidad de alimentos no lo haga y este cambio puede ir acompañado del cambio en la utilización preferente de glucosa por ácidos grasos o viceversa.
Para ellos, la mitocondria debe adaptar sus ‘quemadores’, llamados técnicamente ‘cadena de transporte electrónico (CTE)’. “La adaptación de la CTE mitocondrial era conocida, pero no las señales que promovían este cambio y las moléculas responsables del mismo”, enfatiza el principal responsable de la investigación.
En Cell Metabolism se describen las señales y las moléculas que regulan esta adaptación. En el proceso de quemado de los alimentos en la mitocondria se necesita oxígeno, por lo que se produce normalmente tanto agua (H2O) como CO2, además de la energía. Sin embargo, cuando la CTE no está perfectamente ajustada al tipo de alimento que está quemando (cuando pasa de quemar azúcar a ácidos grasos) se producen además unos derivados del óxigeno llamados especies reactivas de óxigeno (ROS), entre ellos agua oxigenada (H2O2).
La producción de H2O2 activa un sensor molecular llamado Fgr (Fgr-tyrosina kinasa), que interpreta que la organización de los quemadores en la CTE no es adecuada para quemar los ácidos grasos que le están llegando a la mitocondria y da la alarma. Lo hace modificando uno de los elementos de los quemadores (mediante la unión de un fosfato), haciéndolo más activo y causando el cambio en la organización de los quemadores para que sea más adecuado a quemar ácidos grasos. Esta modificación, denominada fosforilación, es reversible.
El grupo del CNIC postula que debe existir otra molécula (aun no descubierta) responsable de revertir esta modificación (defosforilación) cuando los quemadores de la mitocondria deban readaptarse para quemar glucosa de nuevo.
En el trabajo presentado en la revista CELL Metabolism se demuestra la importancia de este mecanismo en la adaptación de las células al ayuno, a la disminución de oxígeno (isquemia) y su importancia en la activación de las células del sistema inmunitario.
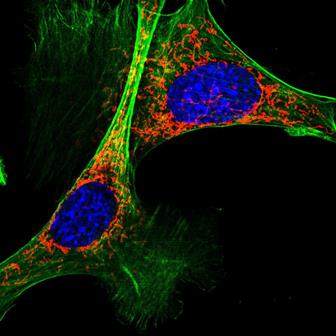
Figura 1.- Imagen de células de ratón en cultivo con los núcleos en azul, las mitocondria en rojo y los filamentos del esqueleto celular en verde (Fotografía tomada por Ana Victoria Lechuga).

Figura 2.- Representación en imagen manga-anime del fenómeno descrito por el grupo del CNIC. El incremento de agua oxigenada (H2O2) activa al sensor Fgr-kinasa que a su vez modifica a uno de los “quemadores” de alimentos de la mitocondria (SDH) causando la optimización para el consumo de ácidos grasos (acuarela realizada por Alba Real)
ROS-Triggered Phosphorylation of Complex II by Fgr Kinase Regulates Cellular Adaptation to Fuel Use










