EXCELENCIA EN DIVULGACIÓN CIENTÍFICA
Las principales revistas científicas publican investigaciones de los laboratorios del CNIC
Nature Cardiovascular Research
El guardián del genoma también protege frente a la enfermedad cardiovascular

Un equipo del CNIC, en colaboración con instituciones estadounidenses, demuestra el papel de las mutaciones adquiridas en el gen p53 en el desarrollo de la enfermedad cardiovascular aterosclerótica. Conocida como el “guardián del genoma”, la proteína codificada por el gen p53 contribuye a mantener la integridad del material hereditario de las células, regulando múltiples funciones celulares en respuesta a diferentes formas de estrés.
Cada día, una persona adulta genera cientos de miles de millones de células sanguíneas. Sin embargo, este proceso necesario facilita la aparición de mutaciones en las células responsables de su producción. Se sabe que la presencia de mutaciones adquiridas en el gen p53 en las células sanguíneas aumenta el riesgo de desarrollar distintos tipos de cáncer, incluyendo cánceres sanguíneos.
En el artículo que se publica en Nature Cardiovascular Research, el grupo dirigido por José Javier Fuster demuestra que dichas mutaciones aceleran también el desarrollo de la aterosclerosis, la causa subyacente a la mayor parte de las enfermedades cardiovasculares, la primera causa de mortalidad en el mundo y una de las mayores cargas económicas para los sistemas sanitarios.
Los investigadores analizaron datos de secuenciación de células sanguíneas de más de 50.000 personas.
“Observamos que los portadores de mutaciones adquiridas en p53 presentan un mayor riesgo de desarrollar enfermedad coronaria y enfermedad arterial periférica, de forma completamente independiente de los factores de riesgo cardiovascular tradicionales, como la hipertensión o los niveles elevados de colesterol en sangre”, explica el Dr. José Javier Fuster.
En base a estos resultados, los investigadores del CNIC realizaron estudios funcionales en modelos animales de aterosclerosis en los que se introdujeron células mutantes en p53.
Los resultados mostraron que los ratones portadores de dichas mutaciones desarrollaron aterosclerosis de forma acelerada, debido principalmente a una proliferación anormalmente elevada de células inmunes en la pared de las arterias.
“Esta combinación de observaciones en humanos y estudios experimentales en animales proporciona evidencias sólidas de que estas mutaciones aumentan el riesgo de desarrollar enfermedad cardiovascular”, asegura el Dr. Fuster.
Para el Dr. Valentín Fuster, director general del CNIC y uno de los autores de la investigación, este trabajo “amplía el conocimiento del papel de las mutaciones adquiridas en células sanguíneas, un fenómeno llamado hematopoyesis clonal, como un nuevo factor de riesgo cardiovascular”.
Los investigadores destacan que los mecanismos por los que mutaciones en diferentes genes contribuyen a la enfermedad cardiovascular son diferentes, “lo que puede en el futuro abrir la puerta a estrategias personalizadas de prevención de la enfermedad cardiovascular dirigidas a los efectos específicos de las distintas mutaciones”, indica Nuria Matesanz, investigadora del CNIC y coprimera autora del artículo.
La contribución de los investigadores del CNIC al estudio ha sido financiada por la Fundación “la Caixa”, la Fundación Leducq, Beca Leonardo 2019 para Investigadores y Creadores Culturales de la Fundación BBVA, y el Instituto de Salud Carlos III (consorcio ERA-CVD ‘CHEMICAL’).
El estudio ha contado también con financiación de los Institutos Nacionales de Salud y la Administración de Veteranos de Estados Unidos
Immunity
Desvelan una nueva diana terapéutica en macrófagos para tratar enfermedades asociadas a la obesidad

Un equipo del CNIC ha descubierto que las necesidades metabólicas de los macrófagos son diferentes en función del órgano en el que residen. Es decir, se adaptan a las necesidades del órgano en el que se encuentran ubicados. Este descubrimiento, explican los investigadores en un artículo publicado en la revista Immunity, “nos permite entender mejor cómo regula el macrófago su metabolismo en función del órgano en el que reside. Además, nos expone una vulnerabilidad de los macrófagos que contribuyen a las enfermedades inflamatorias crónicas, que se podría explotar terapéuticamente en el abordaje de patologías asociadas a la obesidad y al síndrome metabólico, como las enfermedades cardiovasculares”, señala el Dr. David Sancho, líder del laboratorio de Inmunobiología del CNIC y responsable del estudio.
Los macrófagos son células del sistema inmunitario que en condiciones normales están distribuidas por todos los tejidos y sirven para limpiar el organismo de cualquier tipo de material biológico que es necesario eliminar, desde partículas nocivas —como microcristales o virus— a proteínas o complejos más grandes que aparecen durante el desarrollo. Asimismo, son importantes para destruir las células muertas del tejido, facilitando la renovación del órgano.
En este trabajo se desvela que los macrófagos adaptan su metabolismo celular y su función al órgano donde residen. “En los tejidos ricos en grasa y colesterol extracelular, como el pulmón o el bazo, los macrófagos acomodan su metabolismo y adquieren otro más específico dependiente de la actividad mitocondrial para degradar estas grasas a través de la respiración mitocondrial”, señala la Dra. Stefanie Wculek, primera autora del artículo.
En estos tejidos, explica la investigadora, “los macrófagos dependen de la actividad de respiración mitocondrial y, si se interfiere genética o farmacológicamente con dicha actividad, los macrófagos mueren en el pulmón o bazo, pero sobreviven en otros órganos donde no tienen esta dependencia metabólica”.
Por ejemplo, añade el Dr. Sancho, “los macrófagos que se ubican en la grasa corporal o tejido adiposo de personas delgadas no están afectados por mitocondrias disfuncionales porque estas células tienen una actividad metabólica menos dependiente de las mitocondrias al estar plenamente funcionales los adipocitos (células de la grasa), dejando a los macrófagos en estado de reposo”.
En cambio, explica el investigador, “en las personas obesas, el exceso de grasa sobrepasa la actividad normal de los adipocitos y los macrófagos se activan y se convierten en células inflamatorias que promueven el desarrollo de resistencia a la insulina, diabetes tipo 2 y el hígado graso”.
Pero tal y como se ha visto en esta investigación, en este momento “los macrófagos dependen de la respiración mitocondrial para procesar este exceso de grasa, lo que les hace vulnerables a intervenciones terapéuticas, como la inhibición farmacológica de este proceso de respiración mitocondrial”, destaca el Dr. Sancho.
Por tanto, subraya el investigador, hemos visto que “la inhibición de la respiración mitocondrial en estos macrófagos proinflamatorios causa su muerte y esto previene el desarrollo de obesidad, diabetes tipo 2 e hígado graso (síndrome metabólico) en un modelo experimental preclínico en ratón”.
Así, concluyen los investigadores, este hallazgo abre la puerta hacia una nueva vía terapéutica para algunas enfermedades asociadas a la obesidad y síndrome metabólico, como son las enfermedades cardiovasculares.
El estudio ha contado con becas de International Human Frontier Science Program Organization; Fundación “la Caixa”; Ministerio de Ciencia e Innovación (MCIN); Agencia Estatal de Investigación (AEI) y Fondo Europeo de Desarrollo Regional (FEDER); Red de Investigación Biomédica Centro de Fragilidad y Envejecimiento Saludable (CIBERFES-ISCiii); Programa Horizonte 2020 de la Unión Europea ERC-2016-Consolidator Grant, y Comunidad de Madrid (Inmunothercan-CM).
eClinicalMedicine
Así es el corazón normal de un adolescente
La resonancia magnética ha permitido determinar cómo es corazón normal de un adolescente. Un estudio liderado por el CNIC ha utilizado esta disruptiva técnica para desvelar los valores de normalidad de la anatomía y función del corazón en adolescentes, una información publicada en eClinicalMedicine y que tiene implicaciones directas en la práctica clínica.
La resonancia magnética, señala el Dr. Valentín Fuster, Director General del CNIC, coautor del trabajo, “se ha convertido en una de las técnicas de imagen más utilizadas para estudiar el corazón al ser una prueba que no emite radiación y debido a que aporta más información y de mayor precisión a la obtenida por ecografía, la prueba usada más a menudo”.
Sin embargo, la mayor parte de los datos que se tienen de resonancia magnética cardiaca en adolescentes proviene de personas con alteraciones congénitas y otras enfermedades del corazón, por lo que no se conocían bien cuáles eran los valores “normales” en la población general, una información indispensable para poder interpretar adecuadamente los estudios de resonancia magnética cardiaca, reconoce el Dr. Rodrigo Fernández-Jiménez, investigador principal del trabajo, líder del grupo de investigación en Imagen y Salud Cardiovascular en el CNIC y cardiólogo en el Hospital Clínico San Carlos.
Y eso fue precisamente lo que los investigadores del CNIC decidieron determinar. Dentro el proyecto EnIGMA (Early ImaginG Markers of unhealthy lifestyles in Adolescents), y en plena pandemia de Covid-19, este equipo fue capaz de incluir en el estudio a 123 adolescentes, 64 chicas y 59 chicos, provenientes de siete institutos públicos de educación secundaria de la Comunidad de Madrid. Dichos institutos y adolescentes participaban en el Programa SI! de Educación Secundaria, un programa de promoción de hábitos de vida saludable que coordina la Fundación SHE, con el apoyo de la Fundación “la Caixa” y la Universidad de Barcelona.
Tal y como señala el Dr. Borja Ibáñez, director científico del CNIC, coautor del trabajo, “los resultados tienen implicaciones directas en la práctica clínica, pues proporcionan un listado de valores de referencia para multitud de parámetros del corazón utilizados en la práctica diaria, como son las dimensiones y función de las diferentes cámaras cardiacas (aurículas y ventrículos) y la composición del tejido cardiaco”. Así, añade el Dr. Fernández-Jiménez, “esto permitirá conocer si los datos obtenidos del corazón de un adolescente mediante resonancia magnética en cualquier centro entran dentro de lo que se podría considerar “normal” o no, lo que podría implicar esto último que sea preciso un seguimiento más cercano o pruebas adicionales”.
JACC
La terapia anticoagulante a dosis altas mejora la supervivencia en pacientes hospitalizados por Covid-19

El tratamiento anticoagulante a dosis altas puede reducir la tasa de muerte en un 30% y la necesidad de intubación en un 25% en pacientes hospitalizados por Covid-19 que no están en estado crítico, en comparación con el tratamiento estándar, que es la anticoagulación a dosis bajas. Estos son los resultados del ensayo internacional “FREEDOM”, dirigido por el Dr. Valentín Fuster, Director General del CNIC, presidente de Mount Sinai Heart y médico jefe del Hospital Mount Sinai (Nueva York).
Los resultados se presentaron durante las Sesiones Científicas del Colegio Americano de Cardiología, que se celebraron junto con el Congreso Mundial de Cardiología en Nueva Orleans (EE. UU.), y se publicaron simultáneamente en Journal of the American College of Cardiology (JACC).
“Hemos aprendido que muchos pacientes hospitalizados por Covid-19 con afectación pulmonar, pero que no habían sido ingresados en cuidados intensivos (UCI), se beneficiarán de una terapia con enoxaparina subcutánea a dosis altas o de apixaban oral [medicamentos anticoagulantes] para inhibir la trombosis y la progresión de la enfermedad”, afirma el Dr. Fuster.
“Este es el primer estudio que demuestra que la anticoagulación a dosis altas puede mejorar la supervivencia en esta población de pacientes, un hallazgo importante ya que las muertes por Covid-19 siguen siendo frecuentes”, añade el Director General del CNIC.
Al inicio de la pandemia, el Dr. Fuster se percató de que muchos pacientes hospitalizados con Covid-19 desarrollaron altos niveles de trombos sanguíneos potencialmente mortales.
Su investigación demostró que el tratamiento con anticoagulación profiláctica (en dosis bajas) se asociaba a mejores resultados, tanto dentro como fuera de la unidad de cuidados intensivos, entre los pacientes hospitalizados por Covid-19. Los investigadores observaron además que la anticoagulación terapéutica (a dosis altas) podría conducir a mejores resultados.
Por este motivo, diseñaron este ensayo aleatorizado cuyo fin era determinar el régimen y la dosis más eficaces para mejorar los resultados de los pacientes con Covid-19 hospitalizados que no se encuentran en estado crítico.
Entre el 26 de agosto de 2020 y el 19 de septiembre de 2022, reclutaron a 3.398 pacientes adultos hospitalizados con Covid-19 confirmada (media de edad, 53 años) de 76 hospitales de 10 países, entre ellos España. Los pacientes no estaban ingresados en la UCI ni intubados, y aproximadamente la mitad presentaba signos de Covid-19 que afectaban a sus pulmones provocándoles síndrome de dificultad respiratoria aguda (SDRA).
Los participantes fueron aleatorizados para recibir dosis de tres tipos diferentes de anticoagulantes en las 24-48 horas siguientes a su ingreso en el hospital y fueron seguidos durante 30 días.
La información es importante para el manejo de los pacientes con Covid-19 que están lo suficientemente enfermos como para requerir hospitalización, pero no tanto como para necesitar tratamiento en la UCI.
El estudio demostró que la anticoagulación terapéutica era especialmente beneficiosa para los pacientes con SDRA. Entre los pacientes con SDRA en el momento del ingreso hospitalario, el 12,3% del grupo de anticoagulación profiláctica falleció en un plazo de 30 días, frente al 7,9% del grupo de anticoagulación terapéutica.
Todos los grupos presentaron bajas tasas de hemorragia y no hubo diferencias entre los dos anticoagulantes terapéuticos en cuanto a seguridad y eficacia.
NEJM
Un equipo español presenta el primer fármaco para mejorar el síndrome del corazón rígido

Los resultados de un estudio publicado en NEJM pueden cambiar radicalmente el tratamiento de la amiloidosis cardiaca por transtiretina, que es una enfermedad progresiva en la que se produce el depósito de una sustancia (proteína amiloide) en el corazón. Simultáneamente a la publicación en esta revista médica, el Dr. Pablo García-Pavía, jefe de Cardiopatías Familiares del Hospital Universitario Puerta de Hierro e investigador del Centro Nacional de Investigaciones Cardiovasculares (CNIC) y del CIBER Cardiovascular (CIBERCV), presentó, durante el Congreso de Insuficiencia Cardiaca de la Sociedad Europea de Cardiología, los resultados del primer ensayo clínico con un fármaco retirador de amiloide contra la amiloidosis cardiaca por transtiretina.
El estudio supone un gran avance en una enfermedad en la que los tratamientos disponibles hasta ahora, a pesar de que impiden la acumulación de más proteína amiloide y retrasan la progresión de la enfermedad, no actúan contra el amiloide que ya está depositado en el corazón.
El pronóstico de la amiloidosis cardiaca por transtiretina es malo y la supervivencia media de los pacientes sin tratamiento es de sólo 3 años
Los resultados iniciales del estudio, en el que han participado 40 pacientes de Francia, Países Bajos, Alemania y España, muestran que el fármaco es seguro y parece reducir la cantidad de amiloide depositado en el corazón.
Desarrollado por la empresa suiza Neurimmune, el medicamento es un anticuerpo con capacidad de unirse a la sustancia amiloide identificado a partir del análisis de las células memoria tipo B de personas sanas de edad muy avanzada.
En el ensayo que ahora se publica en NEJM, el anticuerpo se administró por vía intravenosa a dosis progresivamente mayores de forma mensual durante 12 meses.
“Los pacientes que recibieron más dosis del fármaco aparentemente tuvieron una mayor reducción de los depósitos de amiloide en el corazón y mayor mejoría de diversos parámetros cardiacos”, señala el Dr. García-Pavía.
Como conclusión, afirma el artículo, este estudio de prueba de concepto de fase I demuestra el perfil de seguridad de este fármaco en estos pacientes y respalda realizar más investigación clínica con este compuesto para que acabe llegando a los pacientes.
El Dr. García-Pavía es uno de los mayores expertos mundiales en esta enfermedad y es el líder del documento sobre diagnóstico y tratamiento de la amiloidosis cardiaca de la Sociedad Europea de Cardiología, las recomendaciones que se siguen a nivel mundial para el diagnóstico y tratamiento de esta enfermedad.
Nature
GLA, el ácido graso que hace que el corazón funcione correctamente después del nacimiento

Un estudio liderado por investigadoras del CNIC ha revelado que la ingesta de leche materna es la señal esencial para que el corazón neonatal madure metabólicamente tras el nacimiento, permitiendo que el corazón funcione correctamente y asegurando la supervivencia posnatal.
En concreto, es el ácido graso omega-6 γ-linolénico (GLA), proveniente de la leche materna, el encargado de unirse a la proteína celular Receptor X de Retinoide (RXR). RXR es una proteína que actúa como sensor nutricional de lípidos y derivados de la vitamina A, alterando la expresión génica e influyendo funciones biológicas tan importantes como la inmunidad, la diferenciación celular o el metabolismo. Una vez RXR detecta el GLA materno, pone en marcha programas genéticos que equipan a la mitocondria, la central energética de las células, con las proteínas necesarias para comenzar a consumir lípidos, la fuente principal de energía en el corazón maduro.
Los resultados publicados en la revista Nature podrían tener vastas implicaciones terapéuticas en patologías cardiovasculares donde existan disfunciones mitocondriales y metabólicas, así como enfermedades relacionadas con alteraciones de procesos madurativos tras el nacimiento, asegura la Dra. Mercedes Ricote, jefa del Grupo de Señalización de los Receptores Nucleares del CNIC y líder de la investigación.
En esta investigación se ha demostrado, en un modelo de ratón, que tanto la ausencia de RXR en el corazón como la falta del ácido graso omega-6 GLA en la leche materna, impiden que las mitocondrias produzcan energía correctamente, conduciendo a un fallo cardiaco severo que acaba provocando la muerte a las 24-48 horas después del nacimiento.
Al nacer, el corazón del bebé debe empezar a producir rápidamente energía para iniciar el latido cardiaco en el ambiente extrauterino. Para ello, los cardiomiocitos, células contráctiles del miocardio, necesitan activar las mitocondrias, orgánulos generadores de ATP (adenosín trifosfato o trifosfato de adenosina) que sustentan las rutas bioenergéticas de la célula. Aunque este proceso es esencial para la supervivencia del organismo, hasta ahora había muy poca información sobre las señales que desencadenan la adaptación fisiológica del corazón tras el parto.
Para la Dra. Ricote, la novedad de este trabajo “reside también en que es la primera vez que se demuestra que, al contrario de lo que se creía, RXR cumple una función esencial en el músculo cardiaco. Este hallazgo supone un avance conceptual muy importante en el campo científico de los receptores nucleares”.
La investigación, cuya autora principal es la Dra. Ana Paredes, propone un ángulo muy novedoso para entender las adaptaciones posnatales que se desencadenan para que el organismo cumpla los requisitos en el ambiente extrauterino. “El nacimiento constituye un desafío fisiológico para el recién nacido”, afirma la Dra. Paredes. “Con este trabajo demostramos que la ingesta de leche materna, además de su función nutricional, cumple un papel señalizador avisando a los cardiomiocitos de que deben activar su metabolismo, porque ya no les sustenta la fisiología materna”.
La investigación, que destaca por su perspectiva multidisciplinar y combinación de técnicas punteras de secuenciación masiva, ha contado con la colaboración de los equipos del CNIC dirigidos por el Dr. José Antonio Enríquez, la Dra. Fátima Sánchez-Cabo y el Dr. Jesús Vázquez.
Además, han intervenido laboratorios nacionales e internacionales: Centro Nacional de Biotecnología y Centro de Investigaciones Biológicas Margarita Salas, ambos pertenecientes al Consejo Superior de Investigaciones Científicas (CNB-CSIC, CIB-CSIC); Universidad Complutense de Madrid (UCM); Universidad de Barcelona (UB); Instituto de Biología Funcional y Genómica/Universidad de Salamanca (IBFG/USAL); CEMBIO/CEU San Pablo; CIBER de Enfermedades Cardiovasculares (CIBERCV), y el Instituto Karolinska (Suecia).
Los resultados, subrayan las investigadoras, abren la posibilidad de modular la actividad de RXR en células cardiacas mediante el uso de fármacos específicos, alguno de ellos aprobados por las autoridades sanitarias de Estados Unidos (FDA) para el tratamiento de algunos cánceres. “Nuestro trabajo propone a RXR como una diana terapéutica potencial de las enfermedades cardiacas neonatales, y en patologías sistémicas provocadas por fallos metabólicos”, concluye la Dra. Ricote.
El estudio ha recibido ayudas a través de becas del Ministerio de Ciencia e Innovación de España (MICIN), Fundació La Marató de TV3 y la Comunidad de Madrid.
Nature Cardiovascular Research
Descubren por qué algunos fármacos angiogénicos para el cáncer y la enfermedad cardiaca causan patología vascular

Una investigación publicada en Nature Cardiovascular Research y realizada por el equipo del CNIC liderado por Rui Benedito ha descubierto que el efecto molecular y celular de algunos medicamentos utilizados para modular la formación de nuevos vasos sanguíneos (angiogénesis), en enfermedades cardiovasculares o en cáncer, no es la causa de la toxicidad y fisiopatología vascular que causan en algunos pacientes.
Los resultados, señala Rui Benedito, director de la investigación, “no solo aumentan significativamente nuestra comprensión de la biología de los vasos sanguíneos, sino que ayudarán a la hora de seleccionar la forma más efectiva y segura de modular la angiogénesis en tejidos isquémicos o en el cáncer”.
Nuestro sistema vascular proporciona oxígeno y nutrientes a todos los tejidos y órganos de nuestro cuerpo. Sin embargo, no son meros conductos pasivos de flujo sanguíneo, sino que contribuyen a la fisiología y la homeostasis de todos los tejidos y órganos a lo largo de nuestra vida. La mayor parte de nuestros vasos sanguíneos están inactivos, pero expresan muchos genes para mantenerse en este estado, incluidos genes de la vía genética mediada por los ligandos Delta y los receptores Notch.
En los últimos años, se han desarrollado diferentes compuestos farmacológicos cuyo objetivo es bloquear o inducir la formación de nuevos vasos sanguíneos (angiogénesis) en enfermedades cardiovasculares o en cáncer.
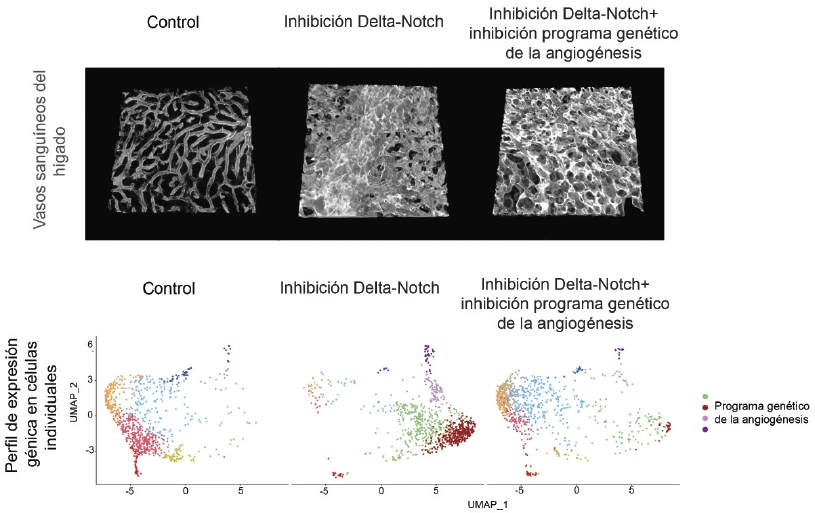
Un grupo de estos compuestos usados en clínica son los que inhiben a diferentes componentes de la vía de señalización de Delta-Notch, una vía muy importante para la angiogénesis, pero también para mantener nuestros vasos sanguíneos en un estado inactivo. Se ha demostrado que estos compuestos, al intervenir en el crecimiento de los vasos sanguíneos, bloquean de manera eficiente el crecimiento de un tumor. Además, se ha comprobado que son capaces de inducir la angiogénesis en tejidos isquémicos y, con ello, mejorar la regeneración y función del tejido.
Sin embargo, dichos compuestos farmacológicos también causan toxicidad vascular en otros órganos sin enfermedades previas, como el hígado o el corazón, razón por la cual ha disminuido el interés clínico hacia ellos.
Hasta ahora, se pensaba que esta toxicidad era debida a la activación de la expresión de genes que promueven la angiogénesis y que llevan a la aparición de neoplasmas o tumores en los vasos sanguíneos.
Gracias al uso de modelos genéticos de ratones avanzados, microscopía confocal de alta resolución, así como técnicas de secuenciación de una única célula, y proteómica, el grupo de Rui Benedito ha descubierto que la toxicidad vascular relacionada con estos compuestos farmacológicos se debe a un cambio en la arquitectura vascular, que impide el correcto flujo sanguíneo.
Los investigadores han demostrado que estos cambios de la arquitectura vascular se producen aunque que se bloqueen la activación celular y la expresión de genes relacionados con la angiogénesis.
Por lo tanto, explica Rui Benedito, “aunque los neoplasmas y la expresión de genes relacionados con la angiogénesis están asociados al cambio en la arquitectura vascular, no son la causa de ese cambio”.
La investigadora Macarena Fernández Chacón, primera autora del estudio, señala que, “después de analizar distintos genes y compuestos farmacológicos dirigidos contra los vasos sanguíneos, hemos encontrado nuevas formas de controlar la angiogénesis patológica sin afectar de manera significativa en la arquitectura vascular de otros órganos y, por ello, sin producir toxicidad”.
El estudio ha contado con el apoyo de las siguientes instituciones: European Research Council (ERC) a través del Starting Grants AngioGenesHD y Consolidator Grant AngioUnrestUHD, Programa Intramural Severo Ochoa, Ministerio de Ciencia e Innovación y Fundación “la Caixa”.
European Heart Journal
La aterosclerosis hace que envejezcamos mucho más rápido

La acumulación de placas en las arterias, la temida aterosclerosis, tiene un importante y desconocido efecto negativo sobre nuestra salud: hace que envejezcamos mucho más rápido.
Lo ha demostrado un estudio de un equipo del CNIC que se publica en European Heart Journal. Los resultados, asegura el Dr. Valentín Fuster, Director General del CNIC e investigador principal del estudio, refuerzan el papel beneficioso de reducir la inflamación a través de, por ejemplo, un estilo de vida saludable —seguir una dieta saludable, hacer ejercicio de forma regular, etc.— o de determinados tratamientos farmacológicos, como las estatinas (fármacos para reducir el colesterol), “que podrían impedir, o al menos, ralentizar la transición de la fase subclínica de la enfermedad a la aparición de eventos cerebro-vasculares graves, como el infarto de miocardio o el ictus”.
La investigación demuestra que existe una fuerte asociación entre la presencia, extensión y progresión de la aterosclerosis a nivel subclínico en las personas jóvenes y sin otras patologías diagnosticadas y la aceleración de la edad epigenética, destaca el Dr. Enrique Lara Pezzi, uno de los autores del estudio.
La edad epigenética de una persona es una forma de calcular la edad biológica (es decir, la edad funcional de sus células y tejidos) utilizando su reloj epigenético. Los relojes epigenéticos utilizan algoritmos de aprendizaje máquina (machine learning) para predecir la edad biológica y la esperanza de vida de una persona a partir de la metilación de su ADN, explica la Dra. Fátima Sánchez Cabo, primera autora del artículo.
Pero en ocasiones, aclara la Dra. Sánchez Cabo, esta predicción puede no ser concordante con la edad cronológica (el tiempo transcurrido desde el nacimiento), “de manera que algunas personas tienen una edad epigenética acelerada respecto a su edad cronológica, mientras que otras tienen una edad epigenética inferior a lo que marca su edad cronológica”.
Afortunadamente, a diferencia de las mutaciones germinales que portamos en nuestro genoma, “los cambios de metilación que se producen en el ADN se pueden revertir, lo que abre un gran abanico de posibilidades para “desacelerar” nuestra edad epigenética”, asegura el Dr. Lara-Pezzi.
La identificación de la asociación entre la aterosclerosis a nivel subclínico y la reducción en la esperanza de vida estimada en base a relojes epigenéticos ha sido posible gracias al análisis masivo de los datos generados en el PESA-CNIC-Santander, un estudio liderado por el Dr. Valentín Fuster.
“El seguimiento de esta cohorte constituye uno de los estudios de prevención cardiovascular más importantes del mundo”, señala el Dr. Fuster.
Además de monitorizar la progresión de la aterosclerosis con técnicas de imagen avanzada, apunta Lara Pezzi, la investigación incluye información pormenorizada del estilo de vida de los participantes, así como estudios moleculares ómicos.
“Estos datos moleculares nos permiten avanzar en el conocimiento de los mecanismos causales de la aterosclerosis subclínica, así como en sus consecuencias clínicas, proporcionando información clave para un tratamiento más personalizado de la enfermedad en estadios tempranos”, indica.
Utilizando datos de transcriptómica y proteómica, el estudio ha demostrado que la inflamación sistémica que se desencadena en aquellas personas con niveles altos de placa aterosclerótica puede ser un factor clave que acelere su edad epigenética. El estudio PESA-CNIC-Santander está cofinanciado por el CNIC y el Banco Santander.
La investigación ha recibido financiación del Instituto de Salud Carlos III y del Fondo Europeo de Desarrollo Regional (FEDER) “Una manera de hacer Europa” y el Ministerio de Ciencia e Innovación (MICIN).













