Jose Luis Cabrera Alarcón, PhD
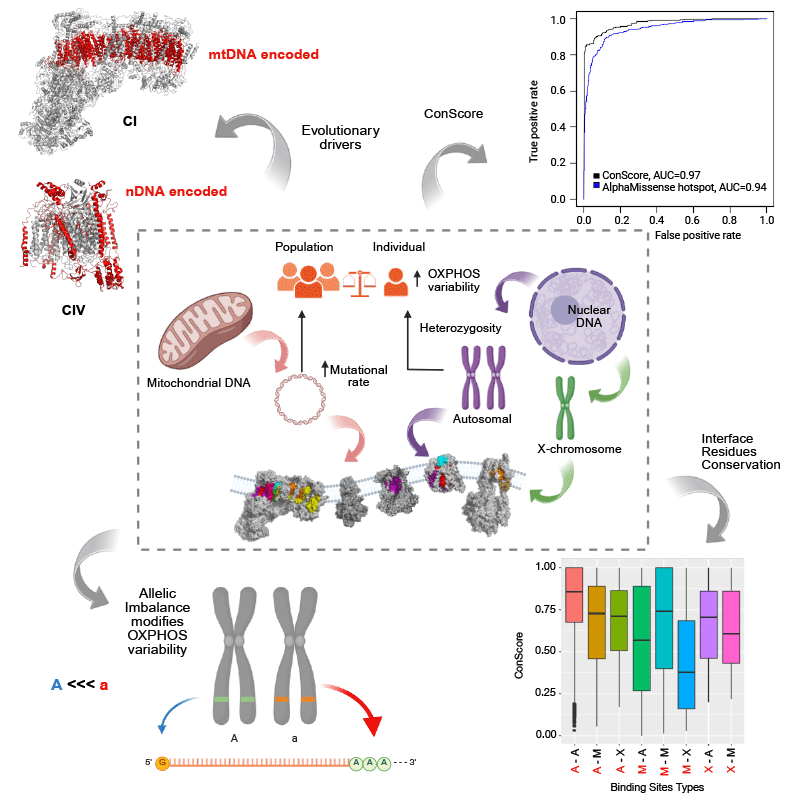
 Durante seis años como investigadora postdoctoral en el grupo GENOXPHOS, he explorado la genética de los componentes de OxPhos, centrándome en la variabilidad a nivel poblacional, la conservación evolutiva y los efectos estructurales para predecir incompatibilidades mitonucleares. Uno de los aspectos de esta investigación consiste en cartografiar, a nivel estructural, las regiones de las subunidades mitocondriales en las que se pueden compensar las variantes patógenas, así como identificar las zonas en las que dicha compensación es más difícil.
Durante seis años como investigadora postdoctoral en el grupo GENOXPHOS, he explorado la genética de los componentes de OxPhos, centrándome en la variabilidad a nivel poblacional, la conservación evolutiva y los efectos estructurales para predecir incompatibilidades mitonucleares. Uno de los aspectos de esta investigación consiste en cartografiar, a nivel estructural, las regiones de las subunidades mitocondriales en las que se pueden compensar las variantes patógenas, así como identificar las zonas en las que dicha compensación es más difícil.

Pablo Hernansanz Agustín, PhD
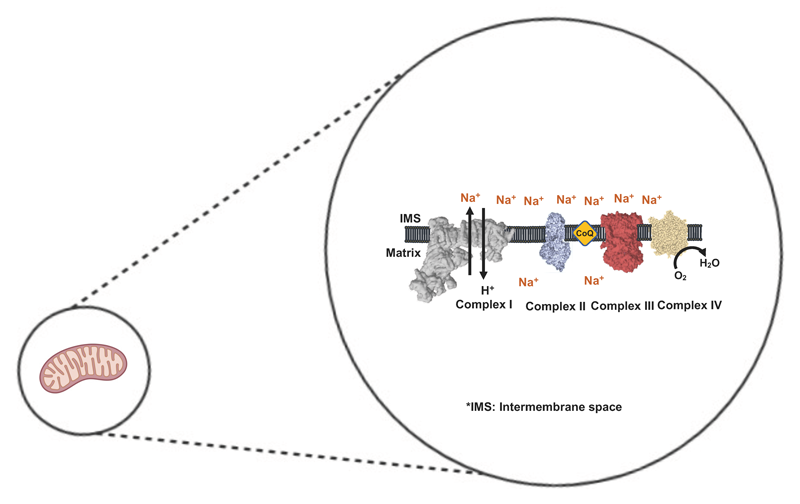
 Mi investigación se centra en el papel del Na+ en la regulación del sistema de fosforilación oxidativa (OXPHOS) relacionado con la bioenergética, el flujo de electrones y la producción de especies reactivas de oxígeno (ROS), así como la relación de todos estos factores con el Parkinson y las enfermedades mitocondriales. Recientemente hemos descubierto que el Na+ establece un gradiente a través de la membrana mitocondrial interna, constituyendo hasta el 50% del potencial de membrana en mitocondrias, mediante la acción de un intercambiador Na+/H+ (NHE) que funciona a través del complejo I (CI). Las mutaciones en este complejo, que afectan únicamente al NHE, están relacionadas con enfermedades neurodegenerativas. Actualmente estamos explorando cómo esta actividad explica un amplio espectro de condiciones (patofisiológicas) y tratando de entender las implicaciones de la desregulación de esta actividad en la salud humana.
Mi investigación se centra en el papel del Na+ en la regulación del sistema de fosforilación oxidativa (OXPHOS) relacionado con la bioenergética, el flujo de electrones y la producción de especies reactivas de oxígeno (ROS), así como la relación de todos estos factores con el Parkinson y las enfermedades mitocondriales. Recientemente hemos descubierto que el Na+ establece un gradiente a través de la membrana mitocondrial interna, constituyendo hasta el 50% del potencial de membrana en mitocondrias, mediante la acción de un intercambiador Na+/H+ (NHE) que funciona a través del complejo I (CI). Las mutaciones en este complejo, que afectan únicamente al NHE, están relacionadas con enfermedades neurodegenerativas. Actualmente estamos explorando cómo esta actividad explica un amplio espectro de condiciones (patofisiológicas) y tratando de entender las implicaciones de la desregulación de esta actividad en la salud humana.
Marta Pérez-Hernández Durán, PhD

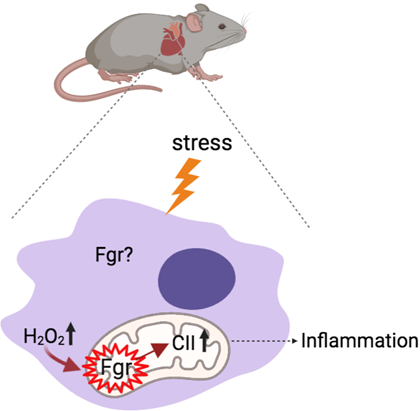
Tras doctorarme en la Universidad Complutense de Madrid en electrofisiología cardiaca, hice una primera etapa postdoctoral en la New York University (E.E.U.U.) estudiando el funcionamiento de los cardiomiocitos en fisiología y en el contexto de la displasia arritmogénica. Posteriormente, me incorporé al grupo GENOXPHOS para estudiar el papel de la quinasa Fgr en el corazón.
Estudios en nuestro laboratorio han demostrado que Fgr se activa bajo estrés celular y, en la mitocondria, fosforila el complejo II de la cadena transportadora de electrones. Esto produce un cambio en el metabolismo celular que, por último, lleva a inflamación.
Mi proyecto estudia el efecto cardioprotector de inhibir Fgr para reducir la inflamación cardiaca. Los resultados de este proyecto podrían ser beneficiosos para tratar enfermedades cardiacas muy variadas que cursen con inflamación, como el infarto, la aterosclerosis, o la displasia arritmogénica del ventrículo derecho.
Para la inhibición farmacológica, estamos colaborando con la empresa Nostrum para desarrollar inhibidores específicos de Fgr.
María Concepción Jiménez Gómez, PhD
 Tras doctorarme en Biología Molecular, por la UAM, comencé a trabajar en el departamento de Investigación y Desarrollo de una empresa biotecnológica española. En 2010, decidí reenfocar mi trayectoria profesional y me uní al grupo Genoxphos, liderado por el Dr. Enríquez en el CNIC. Durante los últimos años, he llevado la gestión de los proyectos del grupo, así como las iniciativas de desarrollo traslacional de los descubrimientos de investigación básica. El grupo Genoxphos colabora en proyectos con líderes en la industria farmacéutica, entre ellos Astrazeneca y Minovia Therapeutics. La continua formación del equipo es fundamental para el grupo Genoxphos. He realizado dos másteres en gestión y administración con objeto de realizar una mejor utilización de los recursos del grupo. Actualmente, curso la carrera de psicología, con objeto de realizar estudios de psicología comparada en los proyectos de investigación.
Tras doctorarme en Biología Molecular, por la UAM, comencé a trabajar en el departamento de Investigación y Desarrollo de una empresa biotecnológica española. En 2010, decidí reenfocar mi trayectoria profesional y me uní al grupo Genoxphos, liderado por el Dr. Enríquez en el CNIC. Durante los últimos años, he llevado la gestión de los proyectos del grupo, así como las iniciativas de desarrollo traslacional de los descubrimientos de investigación básica. El grupo Genoxphos colabora en proyectos con líderes en la industria farmacéutica, entre ellos Astrazeneca y Minovia Therapeutics. La continua formación del equipo es fundamental para el grupo Genoxphos. He realizado dos másteres en gestión y administración con objeto de realizar una mejor utilización de los recursos del grupo. Actualmente, curso la carrera de psicología, con objeto de realizar estudios de psicología comparada en los proyectos de investigación.
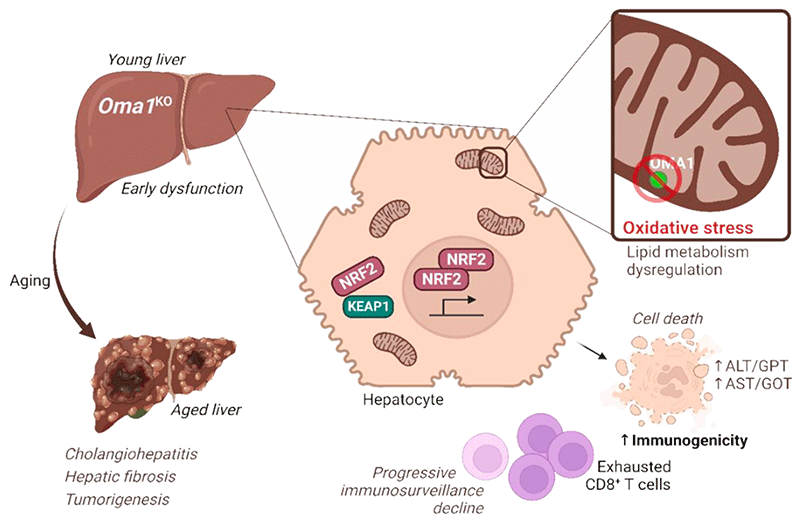
Por otro lado, a nivel de investigación, trabajo en el papel de la metaloproteasa mitocondrial OMA1, como integrador central del estrés en la célula, junto a la Dra. Yolanda Martí. La deleción de OMA1 se ha publicado como protectora en varios contextos patológicos, incluido el fallo cardiaco. Sin embargo, evidencias recientes indican que la deleción de OMA1 puede ser relevante para ciertas patologías. Analizando ratones envejecidos con deleción de OMA1 (ratones Oma1KO), hemos observado un aumento de la mortalidad, así como la incidencia de tumores primarios hepáticos, en comparación con los ratones control (ratones Oma1WT).
Antes de la aparición del tumor, los ratones jóvenes Oma1KO ya muestran daño hepático temprano y un aumento en el estrés oxidativo dependiente de NRF2, que conduce a un aumento de la muerte celular en el hígado. Con el tiempo, las células T Oma1KO CD8+ se agotan progresivamente y el daño hepático temprano observado en Oma1KO progresa hacia una inflamación crónica del hígado, así como fibrosis hepática. La disfunción observada en animales Oma1KO se origina en los hepatocitos, lo que indica que OMA1 protege de la enfermedad hepática crónica y la tumorogénesis controlando la inmunogenicidad del hígado.
Raquel Justo Méndez
Me gradué en biología (Universidad Autónoma de Madrid), y actualmente estoy realizando mi doctorado en Biomedicina Molecular bajo la supervisión de José Antonio Enríquez y Ana Victoria Lechuga-Vieco. En este proyecto evaluamos el impacto de la comunicación entre la mitocondria y el núcleo durante la hematopoyesis en condiciones de distinta variabilidad mitocondrial. Nuestro estudio involucra perfiles inmunológicos, metabólicos y mitocondriales, centrándose en aspectos como la producción de ROS, la organización de los complejos respiratorios y la preferencia de sustratos para obtener energía.
Mediante el uso de ratones deficientes en la actividad correctora de la ADN polimerasa mitocondrial, examinamos el impacto de las células inmunes sobre el envejecimiento y la fragilidad, enfocándonos en la importancia de los mecanismos de control de calidad y de translación mitocondriales.
Carmen Morales Vidal
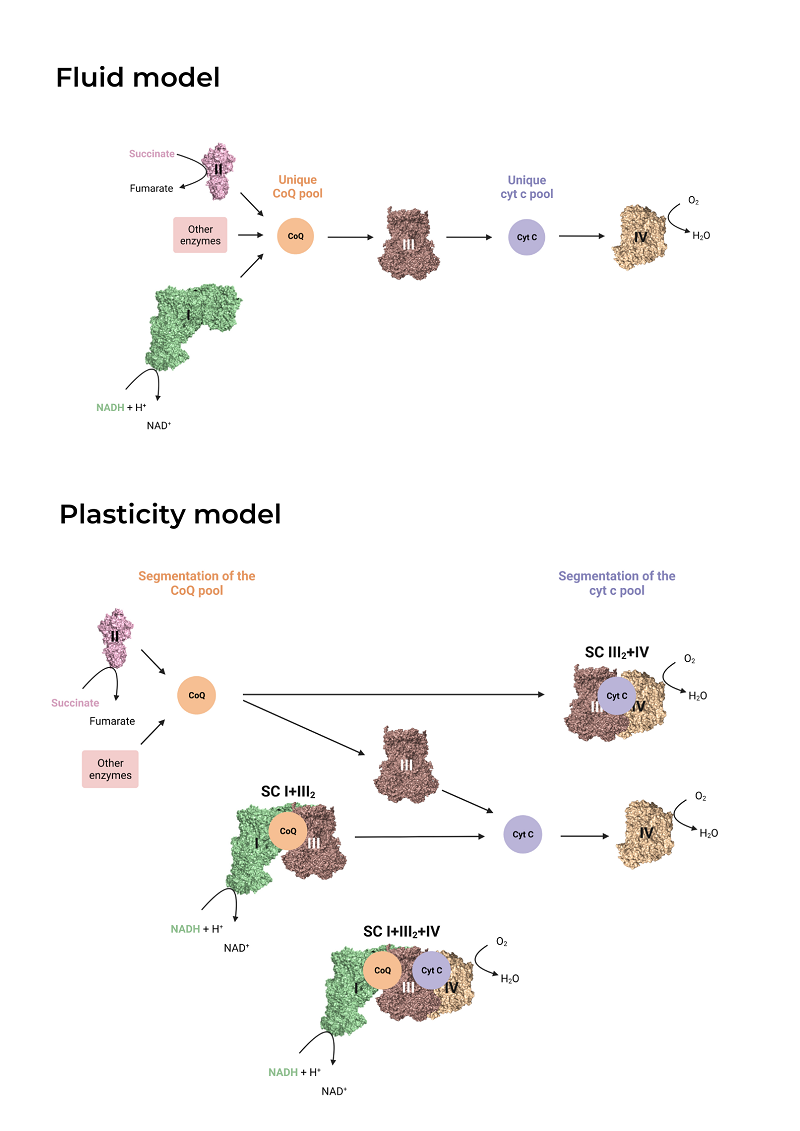
 Tras graduarme en Bioquímica y Ciencias Biomédicas en la Universidad de Valencia en 2020, me uní al grupo Genoxphos como estudiante de máster y, finalmente, como investigadora predoctoral a finales de 2021. Mi proyecto de tesis trata de comprender la razón detrás del superensamblaje de los complejos mitocondriales I (CI) y III (CIII), una interacción que está altamente conservada en la naturaleza, desde levaduras hasta mamíferos, y que da lugar a supercomplejos como el I+III2 y el I+III2+IV. Se han propuesto varias funciones para esta asociación, entre ellas la canalización del sustrato, ubiquinona, de un complejo al otro y la reducción de la producción de especies reactivas de oxígeno. Con tal de estudiar en mayor profundidad el papel de la interacción I+III2 en el funcionamiento de la cadena respiratoria y el metabolismo mitocondrial y celular, actualmente me encuentro generando líneas celulares en donde la interacción entre el CI y el CIII esté interrumpida. Este material de trabajo será el punto de partida para estudiar la importancia de la interacción I+III2 en los seres vivos.
Tras graduarme en Bioquímica y Ciencias Biomédicas en la Universidad de Valencia en 2020, me uní al grupo Genoxphos como estudiante de máster y, finalmente, como investigadora predoctoral a finales de 2021. Mi proyecto de tesis trata de comprender la razón detrás del superensamblaje de los complejos mitocondriales I (CI) y III (CIII), una interacción que está altamente conservada en la naturaleza, desde levaduras hasta mamíferos, y que da lugar a supercomplejos como el I+III2 y el I+III2+IV. Se han propuesto varias funciones para esta asociación, entre ellas la canalización del sustrato, ubiquinona, de un complejo al otro y la reducción de la producción de especies reactivas de oxígeno. Con tal de estudiar en mayor profundidad el papel de la interacción I+III2 en el funcionamiento de la cadena respiratoria y el metabolismo mitocondrial y celular, actualmente me encuentro generando líneas celulares en donde la interacción entre el CI y el CIII esté interrumpida. Este material de trabajo será el punto de partida para estudiar la importancia de la interacción I+III2 en los seres vivos.
Macarena de Andrés Laguillo
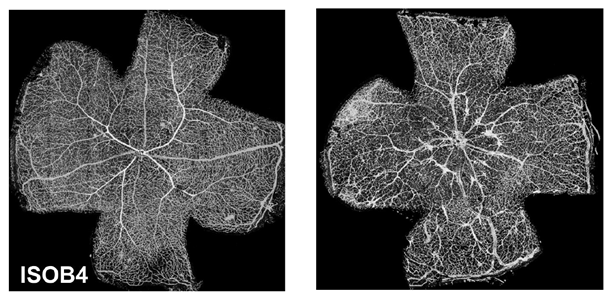
 La enfermedad de VHL, un trastorno genético, se caracteriza por la aparición de tumores vasculares denominados hemangioblastomas, ubicados principalmente en la retina y el cerebro de los pacientes. Nuestra investigación se adentra en los mecanismos moleculares que subyacen a su desarrollo. Utilizando un modelo genético de ratón, pretendemos desentrañar cómo diferentes tipos de células, tanto endoteliales como no endoteliales, contribuyen a la formación de hemangioblastomas. Hemos descubierto que las células deficientes en VHL, con su metabolismo alterado, influyen en el comportamiento de las células vecinas. Además, estamos investigando el papel del factor 2 inducible por hipoxia (HIF2) en este proceso.
La enfermedad de VHL, un trastorno genético, se caracteriza por la aparición de tumores vasculares denominados hemangioblastomas, ubicados principalmente en la retina y el cerebro de los pacientes. Nuestra investigación se adentra en los mecanismos moleculares que subyacen a su desarrollo. Utilizando un modelo genético de ratón, pretendemos desentrañar cómo diferentes tipos de células, tanto endoteliales como no endoteliales, contribuyen a la formación de hemangioblastomas. Hemos descubierto que las células deficientes en VHL, con su metabolismo alterado, influyen en el comportamiento de las células vecinas. Además, estamos investigando el papel del factor 2 inducible por hipoxia (HIF2) en este proceso.
Raquel Martínez de Mena, PhD
 Después de obtener mi doctorado en Ciencias en la Universidad Autónoma de Madrid y tras varios años de investigación centrados en el tejido adiposo marrón y las hormonas tiroideas en el IIB Alberto Sols de Madrid, me uní al equipo del Dr. José Antonio Enríquez.
Después de obtener mi doctorado en Ciencias en la Universidad Autónoma de Madrid y tras varios años de investigación centrados en el tejido adiposo marrón y las hormonas tiroideas en el IIB Alberto Sols de Madrid, me uní al equipo del Dr. José Antonio Enríquez.
A lo largo de los últimos 7 años he aportado mi experiencia en técnicas bioquímicas y de Biología Molecular, enfocado en la Genética Funcional del Sistema de Fosforilación Oxidativa.
Brindo apoyo a nivel científico y técnico y participo activamente en varios proyectos del grupo.
María del Mar Muñoz Hernández
 Me incorporé al grupo GENOXPHOS después de terminar mi formación como técnico de laboratorio y actualmente estoy completando mi formación con el grado de Biología en la Universidad Autónoma de Madrid.
Me incorporé al grupo GENOXPHOS después de terminar mi formación como técnico de laboratorio y actualmente estoy completando mi formación con el grado de Biología en la Universidad Autónoma de Madrid.
En el grupo soy responsable de varios aspectos de la investigación, centrándome, sobre todo, en los modelos animales experimentales. Estos incluyen cría y caracterización genética, además de tener una formación específica en cirugía (especialmente cardíaca) y análisis metabólicos y de comportamiento relacionados con el envejecimiento.
Eva Raquel Martínez

Como técnico de laboratorio, soy responsable de realizar experimentos, analizar muestras y realizar pruebas en un laboratorio. Mi función a menudo implica el uso de diversos instrumentos científicos y garantizar el registro preciso de datos con fines de investigación o diagnóstico.
Dichas técnicas van desde el genotipado de DNA hasta el tratamiento de muestras tisulares con fines diagnósticos.
Marina Rosa Moreno

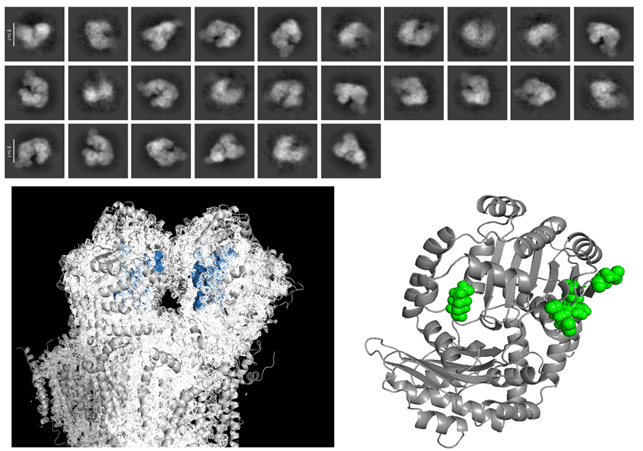
Los complejos de la cadena de transporte electrónico son máquinas intrincadas que deben ensamblar correctamente subunidades codificadas tanto por el genoma mitoncondrial como por el nuclear para su correcto funcionamiento. También presentan subunidades duplicadas, otras codificadas por genes parálogos, etc. Y además, son capaces de formar supercomplejos para cubrir las necesidades metabólicas de las células.
Mi proyecto se basa en el estudio estructural de estos complejos, tanto con modelado computacional in silico como utilizando la herramienta de criomicroscopía electrónica. Estos modelos se pueden utilizar junto con datos genéticos de bases de datos públicas para crear modelos de patogeneicidad y estudios de evolución.
Paula Fernández-Montes Díaz

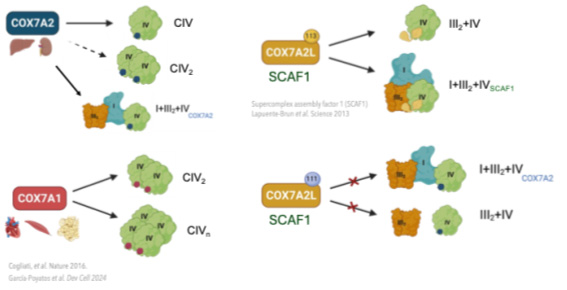
Después de graduarme en Biología en la Universidad Autónoma de Madrid, me uní al grupo GENOXPHOS como estudiante de máster y, finalmente como investigadora predoctoral. En mi tercer año como investigadora predoctoral, estudio el papel de isoformas alternativas del complejo IV, en concreto la familia COX7A. El complejo IV (citocromo oxidasa c) es el último complejo de la cadena de transporte de electrones y está sometido a un gran nivel de regulación. La familia COX7A está conformado por diferentes isoformas: COX7A1, COX7A2 y COX7A2L o SCAF1. Las subunidades alternativas COX7A confieren al complejo IV distinta organización supramolecular, pudiendo aparecer en forma monomérica, dímeros, multímeros y superensamblado con otros complejos formando el respirasoma-Q y el respirasoma-N (Cogliati y Calvo, et al. Nature 2016).
Utilizando modelos murinos y celulares, hemos visto que las estructuras supramoleculares del complejo IV tienen funciones metabólicas y fisiológicas distintas, yendo desde la viabilidad del organismo, la maduración metabólica necesaria para la correcta fisiología tisular, hasta la plasticidad y adaptación a distintos requerimientos metabólicos.
Michaela Veliova, PhD

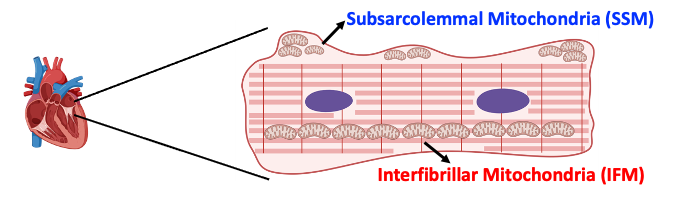
Después de completar mi doctorado en la Universidad de California, Los Ángeles (UCLA), me incorporé al laboratorio GENOXPHOS como investigador postdoctoral para investigar la diversidad intracelular de las mitocondrias en los cardiomiocitos. Mi investigación se centra en comprender las diferencias funcionales entre las mitocondrias interfibrilares (IFM) y las mitocondrias subsarcolemmales (SSM). Estos tipos mitocondriales distintos—o mitotipos—desempeñan roles críticos en la fisiología del cardiomiocito; sin embargo, los mecanismos que permiten su formación y mantenimiento dentro de una sola célula aún no están claros.
Actualmente, estoy explorando cómo los ribosomas citoplasmáticos pueden influir en la diferenciación de los mitotipos, con el objetivo de descubrir cómo se regula la expresión diferencial de proteínas entre estos y cómo el microambiente celular afecta sus perfiles proteómicos y sus características funcionales. A través de este trabajo, espero aportar nuevos conocimientos sobre los procesos que impulsan la diversidad y especialización mitocondrial en los cardiomiocitos.
Rebeca Acín

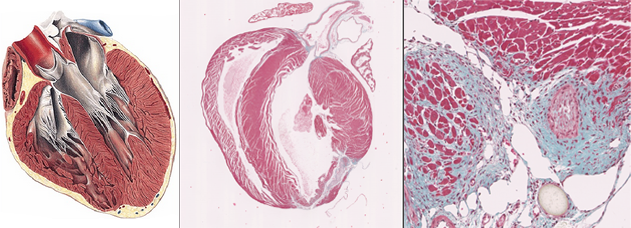
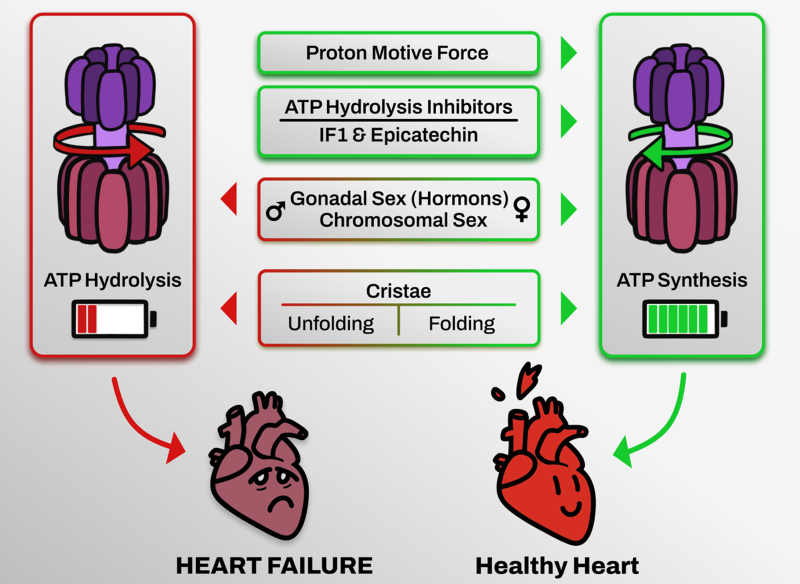
Mi línea de investigación se centra en el estudio del papel de la mitocondria en fallo cardiaco. En particular mi proyecto se centra en dilucidar cómo la depleción de ATP, debido al movimiento en reverso del Complejo V o ATPasa mitocondrial, contribuye al fenotipo adverso y en el estudio del dimorfismo sexual en modelos de insuficiencia cardiaca. Trabajos recientes de nuestro grupo han demostrado que la inhibición de esta actividad reversa del Complejo V es beneficiosa y mejora el rendimiento de la mitocondria en un contexto patológico mitocondrial. Su extrapolación a modelos de fallo cardiaco nos permitirá desarrollar nuevas vías terapéuticas para frenar el deterioro del corazón en enfermedades cardiovasculares. Con esta línea esta línea de investigación también queremos conocer las causas celulares y moleculares de las distintas patologías cardiacas entre hombres y mujeres.
Sara Natalia Jaroszewicz

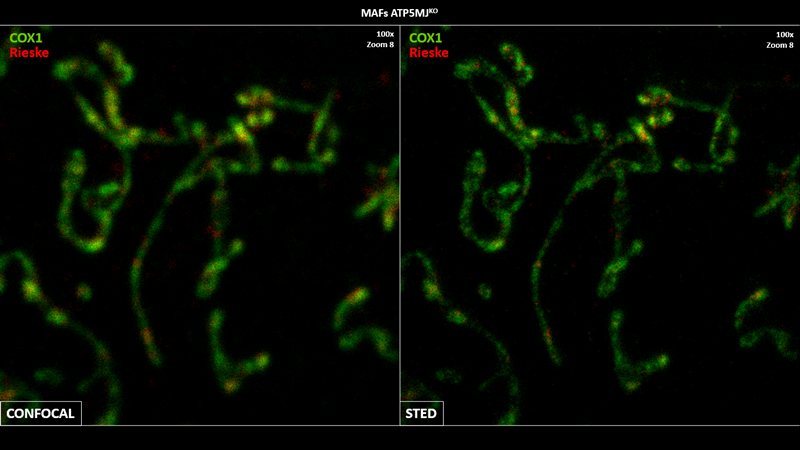
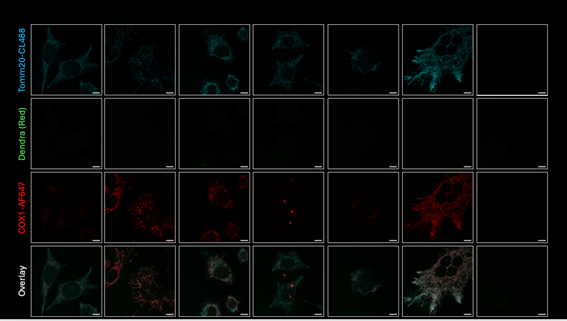
Me gradué en Bioquímica en la Universidad Autónoma de Madrid en 2022 y me incorporé al grupo en verano de ese mismo año como estudiante de prácticas CICERONE y posteriormente como estudiante de Máster. Mi tesis doctoral consiste en descifrar la organización in situ de la cadena de transporte de electrones mediante técnicas de superresolución.
Las mitocondrias son orgánulos esenciales en el metabolismo celular eucariota. En ellas ocurre la fosforilación oxidativa, un proceso mediado por complejos respiratorios (RCs), que pueden ensamblarse en estructuras macromoleculares conocidas como supercomplejos (SCs). Aunque la existencia de los SCs ha sido demostrada, todavía existen dudas acerca de cómo se organizan realmente estos complejos en la membrana mitocondrial interna y cómo su proporción podría influir en el desarrollo de enfermedades cardiacas. Para responder a estas preguntas, mi proyecto se centra en la optimización de los métodos de superresolución STED, Expansion Microscopy (iU-ExM), proximity ligation assay (PLA) y cryoET con el fin de visualizar SCs in situ, determinar su posición fisiológica en subdominios de las crestas mitocondriales y compararlos cuantitativamente en un modelo murino de insuficiencia cardiaca.