Excelencia en divulgación científica
Las principales revistas científicas del mundo, desde el área más básica, como ACS Nano o Science Advances, hasta la biomedicina aplicada a la clínica, como The New England Journal of Medicine o The Journal of American College of Cardiology (JACC), publican la investigación que llevan a cabo los distintos grupos del CNIC
JACC
Demuestran por vez primera que los triglicéridos también tienen un papel importante en el desarrollo de la aterosclerosis
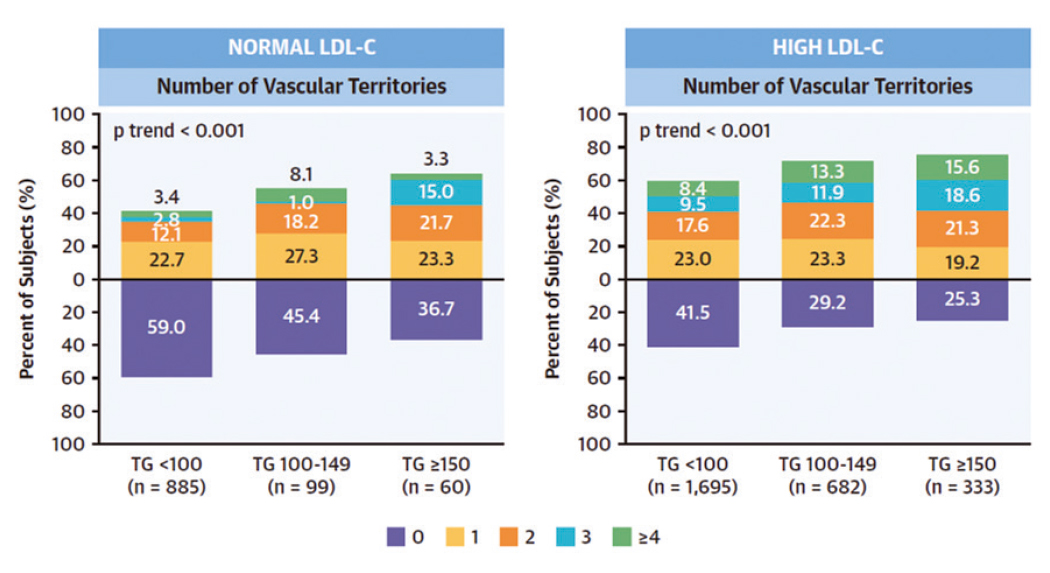
Los triglicéridos pueden ser factor de riesgo cardiovascular tan relevante como el colesterol elevado. Un estudio del CNIC mostró, por primera vez, que, en individuos con riesgo cardiovascular bajo o moderado, la hipertrigliceridemia se asoció con aterosclerosis subclínica e inflamación vascular, incluso en personas con niveles normales de LDL-C o colesterol ‘malo’. Los resultados se publicaron en JACC.
Hasta ahora, los triglicéridos habían quedado relegados a una posición secundaria en la génesis de la aterosclerosis, totalmente ocultos por el colesterol, especialmente el colesterol asociado a lipoproteínas de baja densidad (LDL). De hecho, de forma general, “a la hora de prevenir el desarrollo de aterosclerosis, los expertos no recomiendan tratar los niveles altos de triglicéridos si el colesterol LDL está dentro de la normalidad, salvo que el paciente tenga alto riesgo cardiovascular”, señala el Dr. Sergio Raposeiras-Roubín, primer autor del artículo.
Con este estudio, los investigadores han puesto de manifiesto, por primera vez, que, “en individuos con bajo o moderado riesgo cardiovascular (que son la mayoría de la población), niveles altos de triglicéridos se asocian con un mayor riesgo de aterosclerosis, incluso en pacientes con colesterol LDL normal”.
Este trabajo forma parte del estudio PESA CNIC-Santander (Progression and Early detection of Subclinical Atherosclerosis), un macroproyecto que se está realizando en el CNIC en colaboración con el Banco Santander. El PESA CNIC-Santander, dirigido por el Dr. Valentín Fuster, director general del CNIC, ha aportado información muy relevante sobre la importancia de la detección temprana de la aterosclerosis subclínica debido a su alta prevalencia en la población general.
Además, en el trabajo no solo se ha visto la asociación entre triglicéridos y aterosclerosis, sino también la relación con la inflamación vascular.
El estudio aporta implicaciones importantes para modificar las guías de práctica clínica, haciendo hincapié en la necesidad de controlar no solo el colesterol LDL, sino también los niveles de triglicéridos. “La medición de los niveles de triglicéridos es algo habitual, y afortunadamente disponemos de un arsenal terapéutico apropiado y eficaz para conseguir su control a niveles adecuados”, concluye el Dr. Fuster.
El estudio ha recibido financiación del Instituto de Salud Carlos III y el Fondo de Desarrollo Regional Europeo. El Dr. Ibáñez es beneficiario de un European Research Council Grant MATRIX (ERC-COG-2018-ID: 819775).
ACS Nano
Descrito un potencial mecanismo patogénico en el desarrollo de miocardiopatía hipertrófica
Investigadores del CNIC describieron un potencial mecanismo patogénico en el desarrollo de miocardiopatía hipertrófica (MCH), la enfermedad genética del corazón más común. El estudio, publicado en ACS Nano, detalla, por primera vez, la asociación entre alteraciones mecánicas de un componente de la maquinaria contráctil del corazón y el desarrollo de esta enfermedad.
La miocardiopatía hipertrófica, en la que el ventrículo izquierdo se engrosa anormalmente, es la más común entre las dolencias hereditarias que afectan al músculo cardiaco y sus manifestaciones más graves incluyen la muerte súbita y la insuficiencia cardiaca.
Desde hace más de 20 años, se sabe que diferentes mutaciones en proteínas con función mecánica en los miocardiocitos causan miocardiopatía hipertrófica. Uno de los retos de la genética cardiovascular es identificar qué variantes genéticas que se dan en pacientes y sus familias son patogénicas. Saber si una mutación es patogénica o no es importante, porque define el tipo de seguimiento clínico de los miembros de una familia y, potencialmente, su tratamiento.
El estudio, coordinado por el Dr. Jorge Alegre-Cebollada, ha analizado la proteína c de unión a miosina (cMyBP-C), la proteína más frecuentemente mutada en pacientes con MCH. Una proporción significativa de mutaciones en cMyBP-C causa cambios de aminoácido en la proteína; sin embargo, los mecanismos patogénicos por los que provocan MCH siguen sin conocerse con precisión.
El grupo del Dr. Alegre-Cebollada, en estrecha colaboración con investigadores clínicos y moleculares en Europa y EE.UU., ha configurado una base de datos de variantes en cMyBP-C ligadas inequívocamente con el desarrollo de MCH, para estudiar los defectos moleculares asociados a enfermedad.
Gracias al uso de técnicas bioinformáticas y experimentales, han descubierto que alrededor de la mitad de estas variantes afecta a la integridad del ARN mensajero o de la proteína.
Aunque alteraciones en la integridad del ARN mensajero o proteína pueden explicar la patogenicidad de la mitad de las mutaciones estudiadas en estos trabajos, es importante enfatizar que la otra mitad no causa enfermedad por estas vías.
Gracias al uso de técnicas biofísicas avanzadas basadas en microscopía de fuerza atómica, este equipo describe, por primera vez, cómo algunas de estas mutaciones patogénicas en cMyBP-C inducen defectos en las propiedades mecánicas de la proteína que pueden desembocar en la alteración de la función contráctil de los miocardiocitos en MCH.
La descripción de mecanismos moleculares en MCH es clave para la identificación de mutaciones patogénicas en cMyBP-C y, por tanto, para el seguimiento clínico y potencial tratamiento de los pacientes y sus familias.
La investigación ha sido financiada por el Ministerio de Ciencia e Innovación (MCIN), la Red Europea de Investigación en Enfermedades Cardiovasculares (ERA-CVD/Instituto de Salud Carlos III, consorcio MINOTAUR), la Comunidad de Madrid, los Institutos Nacionales de la Salud de EE.UU. (NIH), el Gobierno Vasco, el Ministerio italiano de Educación, Universidades e Investigación, y Becas Postdoctorales Stanford Dean y del Instituto Maternal and Child Health de Stanford. Además, han colaborado en este trabajo investigadores del Centro de Investigación Biomédica en Red (CIBERCV).

Nature Communications
Identifican factores “indispensables” para la formación de las extremidades
Investigadores del CNIC, en colaboración con el Institut de Recherches Cliniques de Montréal (IRCM) en Canadá, identificaron un grupo de moléculas que resultan esenciales para la formación de las extremidades en desarrollo y su patrón antero-posterior: los factores de transcripción Meis.
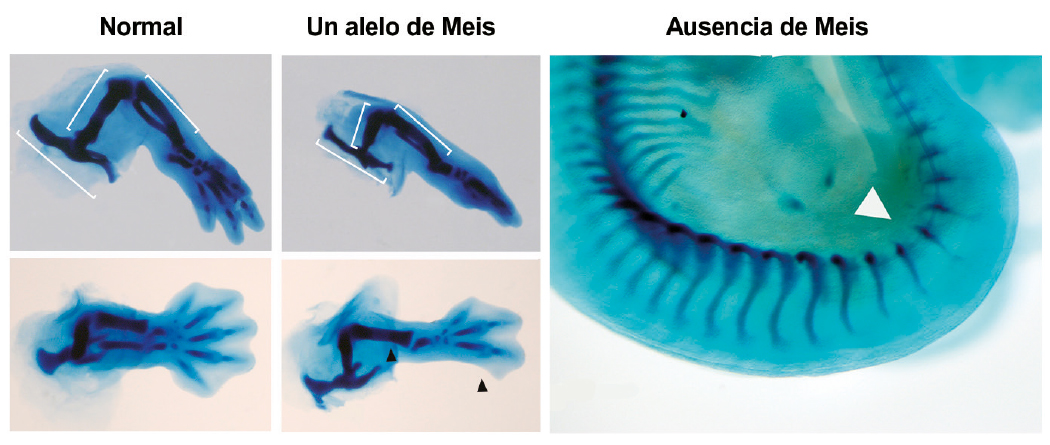
En el estudio, que se publicó en Nature Communications, los científicos han caracterizado la función de los factores de transcripción Meis mediante eliminación total de estas proteínas y han visto que son “indispensables” para la formación de la extremidad. “Un embrión que se desarrolla en ausencia de Meis carece de extremidades”, afirma Miguel Torres, jefe del Grupo de Control Genético del Desarrollo y Regeneración de Órganos del CNIC y coordinador de la investigación.
Gracias al análisis molecular de los embriones, se ha visto que Meis inicia una cascada de señales esencial para el desarrollo del esbozo de extremidad en la que intervienen otros factores esenciales durante el desarrollo de la misma.
El desarrollo embrionario es un proceso muy complejo en el que un gran número de moléculas interaccionan coordinadamente para la correcta formación de un determinado órgano o tejido a partir de unas pocas células. En el caso de la extremidad, inicia su formación como un abultamiento en el flanco del embrión llamado esbozo de extremidad. El crecimiento del esbozo resulta, en último término, en la formación de los elementos esqueléticos de la extremidad.
Y una de las moléculas que tiene un papel crucial en la extremidad en desarrollo, indican los investigadores, son los factores de transcripción Meis. “En un organismo normal —dicen—, los genes Meis se expresan en un estadio muy temprano de la formación del esbozo”.
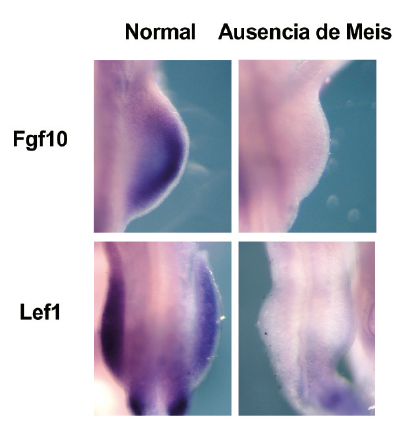
En esta investigación, se ha visto que Meis inicia una cascada de señales esencial para el desarrollo del esbozo de extremidad en la que intervienen otros factores esenciales durante el desarrollo de la misma, como son Fgf10 y Lef1.
Un embrión sin Meis no es capaz de formar extremidades, pero una sola copia, es decir, un solo alelo de estos genes, de los que normalmente hay cuatro, “es suficiente para permitir el inicio de su desarrollo y desvela otras funciones de Meis como son su importancia en la formación de los elementos proximales (pelvis y fémur) y en el establecimiento del patrón antero-posterior de la extremidad”, señala Miguel Torres.
Sin embargo, estos embriones muestran una pelvis y fémur reducidos en comparación con un embrión normal. Además, tienen defectos, o directamente carecen, de elementos esqueléticos posteriores como son el peroné y dedos posteriores.
Los autores, asimismo, identificaron las bases moleculares de estos defectos, que se resumen en un fallo en el inicio de la expresión del gen Sonic Hedgehog, crucial para el establecimiento de la identidad antero-posterior de la extremidad.
JACC
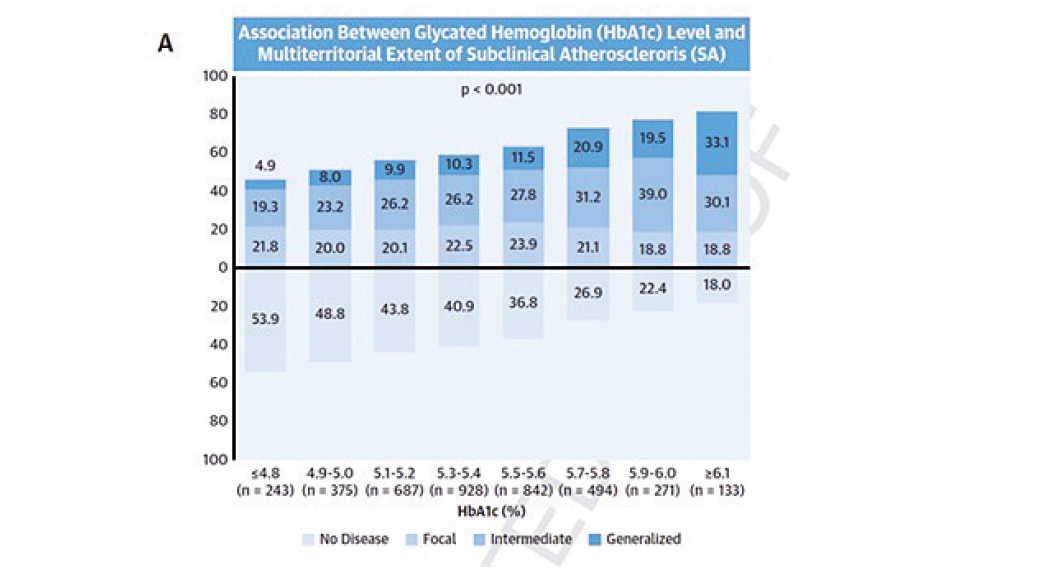
Un biomarcador del nivel de azúcar en sangre identifica pacientes con aterosclerosis y riesgo cardiovascular
El uso rutinario de la hemoglobina glicosilada (un biomarcador indicativo del nivel de azúcar en sangre) en personas no diabéticas ayuda a identificar aquellos pacientes con mayor enfermedad aterosclerótica. Este biomarcador, utilizado para el diagnóstico y el seguimiento de pacientes diabéticos, puede ser de gran utilidad para estimar la enfermedad aterosclerótica y, por tanto, el riesgo cardiovascular en pacientes con o sin una posible prediabetes.
La novedad que propone este estudio del CNIC radica en utilizar el marcador que mide el nivel glicémico en sangre en personas de mediana edad, aparentemente sanas, y que no tienen diabetes mellitus, pero con o sin una posible prediabetes.
El valor añadido de este biomarcador es que, cuando se utiliza para valorar el riesgo cardiovascular junto con los factores de riesgo tradicionales (hipertensión, dislipemia, tabaquismo), mejora la clasificación entre aquellos sujetos con mayor y menor riesgo de enfermedad aterosclerótica.
Además, afirma el estudio que se publicó en JACC, debido a que el estilo de vida saludable reduce los niveles de hemoglobina glicosilada, debería considerarse como la primera opción para reducir el riesgo cardiovascular.
La hemoglobina glicosilada es un test diagnóstico económico, disponible y utilizado ampliamente en la práctica clínica habitual, explica el Dr. Xavier Rosselló, investigador del CNIC y cardiólogo del Hospital Universitario Son Espases de Palma de Mallorca. Por tanto, su uso para ayudar a calcular el grado de aterosclerosis subclínica podría tener una implantación inmediata.
El estudio forma parte del proyecto colaborativo PESA CNIC-Santander, cuyo investigador principal es el Dr. Valentín Fuster. El PESA CNIC-Santander, que se inició en 2010 y se ha renovado hasta 2030, es uno de los estudios de prevención cardiovascular más importantes del mundo.
La enfermedad aterosclerótica se detecta habitualmente en estadios avanzados, cuando ya ha causado daño, como un infarto de miocardio, un accidente cerebrovascular u otros eventos cardiovasculares. El pronóstico de las personas cambia radicalmente si han presentado alguno de estos eventos clínicos, por lo que la detección precoz de la patología que produce dichos eventos (aterosclerosis) es vital para mejorar la cantidad y calidad de años de vida de la población.
Los autores concluyen que “este hecho convierte a la hemoglobina glicosilada en un biomarcador de masas, ya que su principal aplicación se ubica en el estrato de sujetos de menor riesgo, donde se concentra la inmensa mayoría de la población general, y donde, en términos absolutos, se producen el mayor número de muertes cardiovasculares”.
El estudio ha recibido fondos del Instituto de Salud Carlos III (ISCIII, PI15/ 02019, PI17/00590, PI20/00819) y el European Regional Development Fund (ERDF) ‘A way to make Europe’ y ha contado con investigadores del CIBER de enfermedades cardiovasculares (CIBERCV).
NEJM
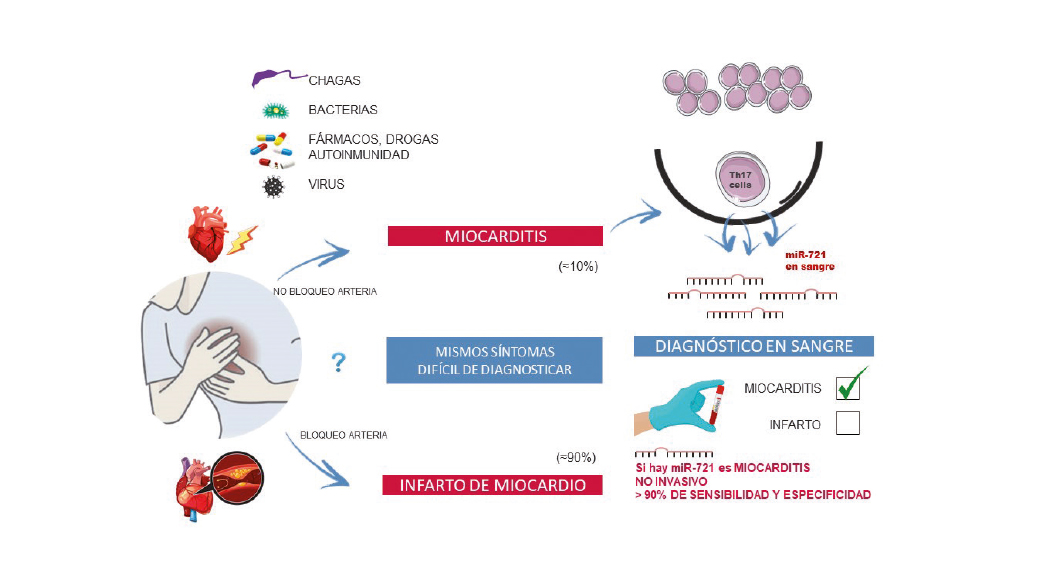
Primer biomarcador en sangre que distingue la miocarditis de un infarto agudo de miocardio
Investigadores del CNIC han identificado el primer biomarcador en sangre para la miocarditis, una patología del corazón cuyos síntomas y signos son muy similares a los de un infarto de miocardio. En la actualidad no existe ninguna prueba no invasiva capaz de diferenciar entre ambas patologías, y por ello en la gran mayoría de casos es necesario realizar un cateterismo urgente (prueba invasiva) para poder diagnosticar correctamente al paciente.
El estudio, liderado por la Dra. Pilar Martín y publicado en la revista The New England Journal of Medicine, ha identificado la presencia de un biomarcador, un nuevo microARN (miR-721 homólogo humano) en sangre exclusivamente en pacientes con miocarditis aguda.
Los resultados de este trabajo tienen una gran relevancia, ya que validan el primer marcador en sangre que presenta una alta sensibilidad y especificidad (superior al 90%) para diagnosticar miocarditis y discriminar a los pacientes con esta enfermedad de otros con diferentes miocardiopatías, como el infarto agudo de miocardio, y también de otras enfermedades inflamatorias de origen autoinmune.
“Nuestro hallazgo puede convertirse en una nueva herramienta útil en la práctica clínica que permita un diagnóstico preciso y no invasivo de la miocarditis con tan solo una gota de sangre”, añade la Dra. Martín, cuyo proyecto ha sido financiado con la Beca Leonardo para Investigadores de la Fundación BBVA.
La miocarditis es una enfermedad inflamatoria del corazón causada por patógenos infecciosos, toxinas, fármacos o trastornos autoinmunes que, si no se trata, puede evolucionar a una miocardiopatía dilatada, a la necesidad de recibir un trasplante de corazón o incluso causar la muerte.
Su prevalencia real sigue siendo incierta debido a la dificultad de lograr, en muchos casos, un diagnóstico confirmatorio.
Su diagnóstico suele establecerse tras descartar la enfermedad arterial coronaria mediante angiografía coronaria invasiva o tomografía computarizada (TC), y posterior confirmación mediante biopsia endomiocárdica (prueba diagnóstica ‘gold standard’). Debido a que la biopsia cardiaca es agresiva, suele reservarse para los casos graves. Una alternativa a la biopsia es la resonancia magnética cardiaca (RMC), sin embargo, no está disponible en todos los centros.
Además, pese a que la causa más frecuente de miocarditis es una infección viral, también puede ser secundaria a algunos tratamientos de otras patologías. De hecho, la miocarditis es un efecto secundario que, aunque es muy raro, es potencialmente grave en pacientes con cáncer que están recibiendo un tratamiento con los inmunoterápicos llamados ‘immune checkpoint inhibitors’.
No obstante, tampoco existen marcadores específicos para diagnosticar los pacientes susceptibles de desarrollar miocarditis durante el tratamiento del cáncer con inmunoterapia.
El CNIC es el único propietario de una patente relacionada con el biomarcador y su uso para el diagnóstico de miocarditis, y está en contacto con socios industriales interesados en su licencia que puedan contribuir al desarrollo y comercialización para que la tecnología llegue a los pacientes.
El estudio ha contado con la financiación del Ministerio de Ciencia e Innovación (MICINN), a través del Instituto de Salud Carlos III (ISCIII)-Fondo de Investigación Sanitaria; CIBERCV; Comunidad de Madrid; Beca Leonardo para Investigadores de la Fundación BBVA; Fundació La Marató TV3; European Research Council grants ERC-2011-AdG 294340-GENTRIS to F.S-M., and ERC-2018-CoG 819775-MATRIX to B.I., y Ministerio de Ciencia e Innovación (MICINN).

JITC
Descubren una nueva estrategia para potenciar la inmunoterapia en el cáncer
Investigadores del CNIC hallaron una nueva estrategia para potenciar la inmunoterapia, el tratamiento que ha revolucionado el manejo del cáncer. En concreto, en el estudio que se publicó en Journal for Immunotherapy of Cancer, el equipo del Dr. David Sancho ha identificado un mecanismo por el que las células muertas del tumor frenan la respuesta del sistema inmunitario, reduciendo así la capacidad antitumoral de las células inmunitarias que atacan al cáncer.
Los investigadores han logrado mejorar la eficacia de la inmunoterapia antitumoral a través de una estrategia combinada, basada en anticuerpos bloqueantes y en combinación con citoquinas o tratamientos quimioterápicos que favorecen el desarrollo de un tipo de células (dendríticas), y creen que dicha táctica podría ser trasladada a la clínica para optimizar la inmunoterapia del cáncer.
La inmunoterapia consiste en reprogramar el sistema inmunitario propio para que reconozca y elimine a las células tumorales.
Sin embargo, no todos los pacientes pueden beneficiarse de estos tratamientos porque muchos cánceres desarrollan mecanismos de evasión inmune. Uno de estos mecanismos consiste en impedir la migración de células del sistema inmunitario al microambiente tumoral. “El sistema inmunitario tiene la capacidad de entrar en ese entorno e infiltrarse en el tumor para acabar con él, mejorando así el pronóstico de los pacientes. No obstante, esto no siempre ocurre y el objetivo de este proyecto ha sido potenciar esta habilidad”, explica el Dr. Sancho, jefe del Laboratorio de Inmunobiología del CNIC y coordinador del estudio.
El tipo de células inmunitarias que se introducen en el tumor se asocia con la supervivencia de pacientes con cáncer. En concreto, se ha relacionado una mayor supervivencia al cáncer con la infiltración por linfocitos T CD8, células que eliminan los tumores, y con ciertos subtipos de células dendríticas que atraen y activan a estos linfocitos.
Por ello, la comunidad científica se ha centrado en la búsqueda de terapias que aumenten estas células inmunitarias en el microambiente tumoral.
Se sabe que las células del sistema inmunitario están dotadas de un extenso repertorio de receptores que le permiten interactuar con su entorno, reconociendo patógenos, pero también siendo capaces de identificar daño tisular. “En el caso del cáncer, una mayor inflamación que facilite la infiltración de células inmunitarias en el microambiente tumoral podría facilitar la eliminación de células tumorales por el sistema inmunitario”, asegura el Dr. Sancho.
Las células dendríticas, indica el Dr. Carlos del Fresno Sánchez, investigador financiado por la Asociación Española Contra el Cáncer en el CNIC y actualmente investigador Miguel Servet en el Instituto de Investigación del Hospital La Paz (IdiPAZ), pertenecen a la denominada inmunidad innata, la primera barrera de defensa del organismo, y su presencia en el entorno que rodea al cáncer puede “favorecer en gran medida la respuesta del sistema inmunitario contra el tumor y mejorar la evolución de los pacientes”.
En este nuevo estudio, los investigadores han observado que el reconocimiento de células muertas en el tumor a través del receptor DNGR-1 expresado en células dendríticas previene la infiltración del tumor por células dendríticas y, por tanto, por los linfocitos T CD8 que eliminan el tumor, de modo que impide que el sistema inmunitario pueda actuar frente al tumor. A través de anticuerpos bloqueantes de este receptor y en combinación con citoquinas o tratamientos quimioterápicos que favorecen el desarrollo de células dendríticas, los investigadores han logrado mejorar la eficacia de la inmunoterapia antitumoral.
Es decir, tocando las teclas adecuadas, se puede favorecer la actividad de estas células inmunitarias contra el cáncer. Y estas teclas son, por un lado, la administración de un elemento llamado Flt3L y, por otro, el bloqueo de una molécula de su superficie llamada DNGR-1. Explican los investigadores que Flt3L funciona como un “estimulante”, ya que su administración hace que el número de células dendríticas aumente y favorece su entrada en el microambiente tumoral. En este aspecto, los investigadores han identificado que la citoquina Flt3L, además de poder administrarse como un fármaco, puede producirse en el propio organismo en respuesta a ciertos tratamientos quimioterápicos.
El estudio, concluyen, muestra una nueva herramienta para hacer frente al cáncer aprovechando las defensas del propio organismo.
El estudio ha sido financiado por la Fundación “la Caixa”, la Asociación Española Contra el Cáncer (AECC), el National Institute for Health Research Manchester Biomedical Research Center, el European Research Council (ERC-2016-Consolidator Grant 725091), la European Commission (635122-PROCROP H2020), el Ministerio de Ciencia, la Agencia Estatal de Investigación (AEI), Fondo Europeo de Desarrollo Regional (FEDER) (SAF2016-79040-R), el consorcio IMMUNOTHERCAN de la Comunidad de Madrid, beca FIS-Instituto de Salud Carlos III, Fundación Acteria, Atresmedia (Constantes y Vitales) y Fundació La Marató de TV3.

Nature Communications
La inhibición de dos proteínas activadas por el óxido nítrico revierte los aneurismas de aorta del síndrome de Marfan
Un trabajo del CNIC y del Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM) descubrió que la ruta del óxido nítrico (NO) está sobreactivada en la arteria aorta tanto de ratones como de pacientes con Síndrome de Marfan, y que dicha ruta es responsable de los aneurismas aórticos característicos de este síndrome.
Los resultados del estudio, publicado en la revista Nature Communications, evidencian el papel determinante que el NO desempeña en la enfermedad aórtica del Síndrome de Marfan e identifican nuevas dianas terapéuticas y marcadores de activación de esta ruta que podrían ser útiles para la monitorización de la enfermedad y su seguimiento.
El aneurisma aórtico es una dilatación progresiva y debilitamiento de la pared de la arteria aorta. Dicho aneurisma puede ser inocuo e indolente, pero en ciertos casos se produce la disección (o desgarro) de la aorta en estas regiones aneurismáticas, llevando a la muerte del paciente, explican los investigadores.
Los resultados del estudio han permitido identificar nuevos biomarcadores asociados a este síndrome que podrían potencialmente ayudar en el seguimiento clínico y pronóstico de pacientes con este síndrome
El Síndrome de Marfan es un trastorno hereditario que afecta al tejido conjuntivo, es decir, las fibras encargadas de cohesionar y sujetar todos los órganos y sistemas de nuestro cuerpo. Las principales afecciones de este síndrome se producen en el esqueleto, los ojos, el corazón y los vasos sanguíneos, siendo de especial relevancia la generación de aneurismas aórticos y disecciones (TAAD).
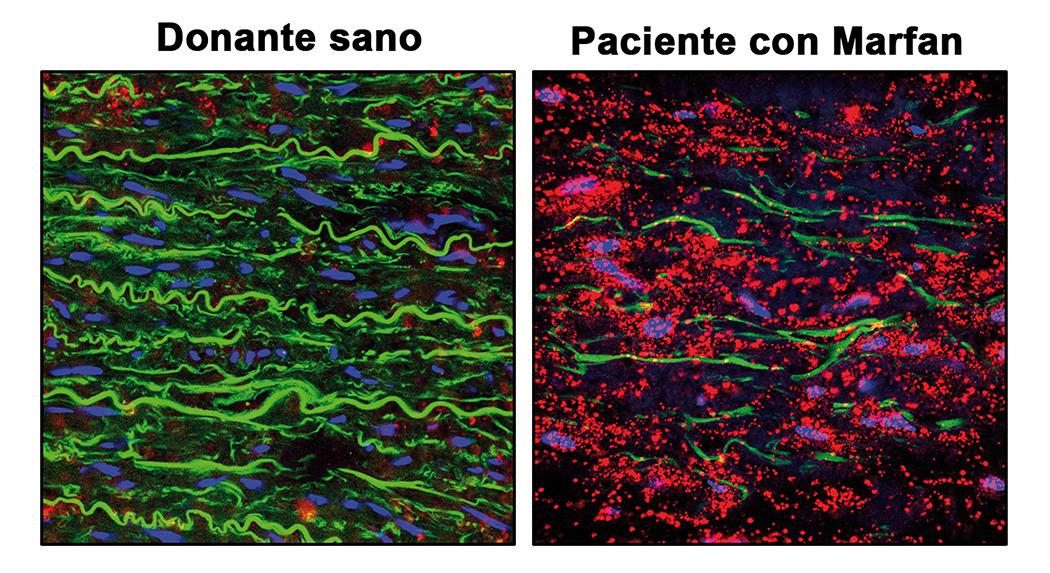
De hecho, comenta el Dr. Juan Miguel Redondo, del CNIC, codirector del estudio junto al Dr. Miguel Campanero, del CBM-CSIC-UAM, “más del 90% de la mortalidad de este síndrome se debe a disecciones aórticas”.
Actualmente, los fármacos utilizados para el tratamiento del Síndrome de Marfan están dirigidos a reducir la presión sobre la pared arterial, pero no previenen su deterioro. La intervención quirúrgica es el único tratamiento efectivo existente para la aortopatía que acompaña al síndrome.
Por ello, aseguran los investigadores, “urge la identificación de nuevas dianas terapéuticas para el desarrollo de estrategias farmacológicas que ayuden a tratar los TAAD presentes en el Síndrome de Marfan”.
El trabajo descubre el papel esencial del NO en la enfermedad aórtica del Síndrome de Marfan.
Dada la importancia que el NO ha demostrado tener en el desarrollo de TAAD, los investigadores decidieron centrarse en el estudio de la enzima guanilato ciclasa soluble (sGC) y de la proteína quinasa dependiente de cGMP tipo I (PRKG1), dos proteínas reguladas por el NO. “Nuestro estudio ha revelado que tanto la sGC como la PRKG1 tienen niveles de actividad elevados en las muestras obtenidas de ratones y pacientes Marfan”, asegura el Dr. Redondo.
“De hecho, inhibidores farmacológicos de estas dos proteínas o el silenciamiento génico de Prkg1 son capaces de revertir por completo la aortopatía presente en ratones Marfan. Esto demuestra que la ruta del NO-sGC-PRKG1 media el desarrollo de TAAD en este síndrome”, añade el Dr. Campanero.
Debido a la necesidad del desarrollo de nuevas estrategias farmacológicas para el tratamiento de la aortopatía en el Síndrome de Marfan, destaca el Dr. Redondo, “este estudio abre la puerta al uso de inhibidores de la sGC y la PRKG1 en ensayos preclínicos y clínicos para esta enfermedad y posiblemente también para otras enfermedades aórticas”.
Además, los investigadores han analizado las posibles “huellas” que los altos niveles de NO podrían haber dejado en la sangre.
Esto, señala el Dr. Redondo, “es un descubrimiento que puede ser importante para los pacientes con este síndrome, ya que dichas moléculas podrían usarse como biomarcadores para el seguimiento de la enfermedad y cuyo potencial valor pronóstico estamos estudiando”.
El estudio ha sido financiado por la Fundación “la Caixa” a través de su Convocatoria CaixaResearch de Investigación en Salud con 500.000 euros, el Ministerio de Ciencia, Investigación y Universidades, la Comunidad de Madrid, el CSIC, la Fundación Pro CNIC, la Fundación Marfan de EE.UU., la Fundación La Marató y el CIBER de enfermedades cardiovasculares (CIBERCV) del Instituto de Salud Carlos III.

JACC
Resonancia magnética cardiaca ultra-rápida que analiza el corazón en menos de un minuto
Investigadores CNIC y Philips han desarrollado una técnica revolucionaria que permite realizar una resonancia magnética cardiaca (RMC) en menos de un minuto. Esta resonancia magnética cardiaca ultra-rápida, denominada ESSOS (Enhanced SENSE by Static Outer volume Subtraction), posibilita una evaluación precisa de la anatomía y la función del corazón y, además, reduce los costes e incrementa la comodidad del paciente. Los resultados se publicaron en JACC: Cardiovascular Imaging.
La RMC es la técnica idónea para estudiar la anatomía, función y hasta composición celular del corazón; permite explorar el corazón de manera no invasiva y sin radiación. Y, a pesar de que la gran mayoría de hospitales dispone de equipos de resonancia magnética, su uso para el estudio del corazón de pacientes es limitado. La principal causa es el tiempo necesario para hacer un estudio completo. Un estudio completo precisa de entre 45-60 minutos, un periodo que, por su extensión, hace que muchos pacientes no terminen la prueba debido a la incomodidad o malestar que les provoca.
Por otro lado, los equipos de resonancia magnética de los hospitales realizan otro tipo de estudios, no solo de corazón, lo que dificulta todavía más la realización de estudios cardiacos de tan larga duración.
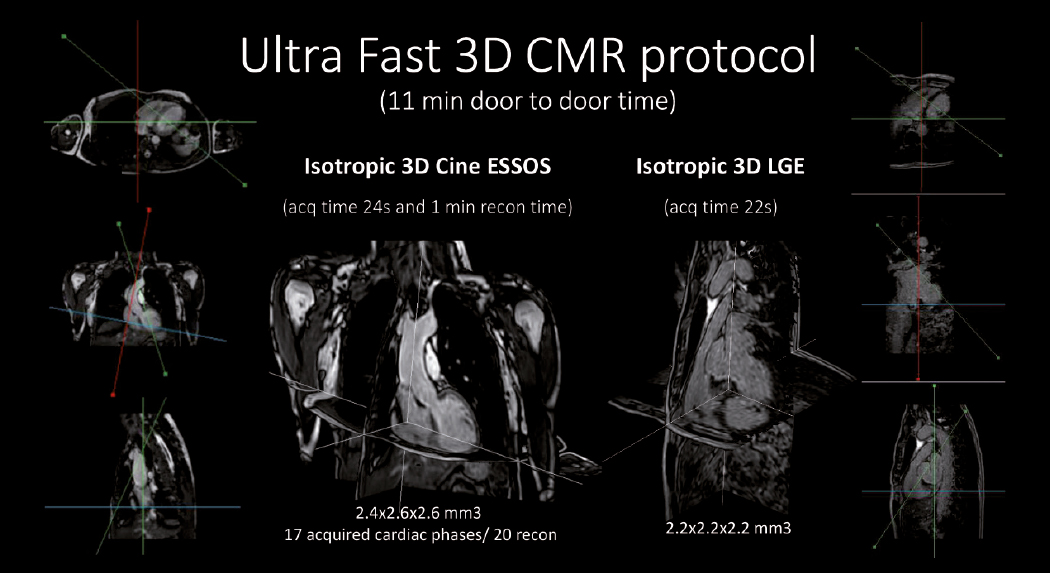
La nueva técnica permite estudiar la anatomía y función (motilidad) del músculo cardiaco, así como las áreas cardiacas que han sufrido un infarto o que tienen fibrosis. Asimismo, incorpora la posibilidad de analizar toda la caja torácica en 3D y, mediante algoritmos matemáticos, focalizarse únicamente en el corazón y los grandes vasos (parte móvil), con lo que se reduce el tiempo del estudio.
La nueva tecnología ha demostrado en un grupo numeroso de pacientes, 100, que la resonancia cardiaca obtiene los mismos parámetros que la técnica habitual, pero reduciendo en más de un 90% el tiempo que el paciente tiene que estar dentro de la máquina, señala el Dr. Borja Ibáñez, director del Departamento de Investigación Clínica del CNIC.
Los investigadores destacan que ESSOS, tecnología protegida mediante una patente conjunta entre el CNIC y Philips y que es fruto del trabajo conjunto entre el CNIC y Philips de casi 10 años, va a revolucionar el mundo de la imagen cardiaca.
Tal y como explica el Dr. Javier Sánchez, científico de Philips que lidera la colaboración con el CNIC, y líder de este trabajo, ESSOS permite obtener las imágenes de una forma 34 veces más rápida que cuando se hace con tecnología estándar utilizada actualmente. “En poco más de 20 segundos se ha adquirido toda la información necesaria para conocer la forma y función del corazón”, indica el experto de Philips. Y, además, añade, “si se precisa averiguar si se ha producido fibrosis o infarto, se lleva a cabo otra adquisición de 20 segundos. Con esto se finaliza el estudio cardiaco; es decir, menos de un minuto”.
Por último, destacan los investigadores, esta metodología puede implementarse en equipos de resonancia magnética ya existentes.
La investigación ha sido financiada por el Instituto de Salud Carlos III, a través de un proyecto FIS de desarrollo tecnológico, así como una Beca de Investigación Traslacional de la Sociedad Española de Cardiología, el Consejo Europeo de Investigación (ERC) y la Comunidad de Madrid (Red Madrileña de Nanomedicina en Imagen Molecular).
JACC
Investigadores del CNIC explican cómo la hipertensión arterial acelera la aterosclerosis
La hipertensión arterial, la causa más importante de enfermedad en el mundo, acelera la aterosclerosis; sin embargo, se desconoce el mecanismo que causa este efecto. Ahora, investigadores del CNIC y la Universidad de Aarhus (Dinamarca) demuestran que la hipertensión arterial altera la estructura de las arterias, lo que provoca una mayor acumulación de colesterol LDL y un desarrollo más rápido de la aterosclerosis. El estudio se publicó en JACC.
Los medicamentos para controlar y reducir la hipertensión arterial, los antihipertensivos, se usan de forma rutinaria para prevenir el desarrollo de aterosclerosis y las enfermedades cardiacas, a pesar de que se desconoce el mecanismo de dicho efecto. Las personas con hipertensión arterial, a menudo, sufren cambios en las hormonas que controlan la tensión arterial y no está claro si es la presión en sí misma o los cambios hormonales el motor que acelera la aterosclerosis.
Los científicos emplearon un modelo de minicerdos modificados genéticamente, que tienen niveles altos de colesterol en sangre y desarrollan aterosclerosis.
Al manipular la tensión arterial en los animales y analizar los efectos sobre las arterias del corazón, los investigadores encontraron que la presión directa sobre las arterias produce cambios estructurales que facilitan el desarrollo de la aterosclerosis. “Las arterias se vuelven más densas y permiten un menor paso de moléculas de la sangre, incluyendo las partículas de LDL que transportan el colesterol, las cuales terminan acumulándose en la capa más interna de las arterias, donde promueven el desarrollo de la aterosclerosis”, explica el Dr. Jacob Bentzon, coordinador del estudio.
Aunque se sabe desde hace décadas que la acumulación de partículas de LDL en las arterias conduce a la aterosclerosis, esta investigación demuestra que la hipertensión acelera la acumulación de LDL y, por ello, agrava el efecto de tener niveles elevados de colesterol LDL en la sangre.
Asimismo, estos datos respaldan la necesidad de mantener niveles adecuados de colesterol LDL y de controlar la hipertensión durante toda la vida mediante una dieta saludable, control de peso, ejercicio y, cuando sea necesario, fármacos. “También podrían allanar el camino para el desarrollo de terapias más efectivas dirigidas a contrarrestar los efectos perjudiciales de la hipertensión sobre la aterosclerosis”, concluyen los investigadores.
La investigación es una colaboración entre el Grupo de Patología Experimental de la Aterosclerosis, que dirige el Dr. Jacob Fog Bentzon, y los grupos de Proteómica Cardiovascular del CNIC, el CIBER de enfermedades cardiovasculares y la Unidad de Investigación de Aterosclerosis de la Universidad de Aarhus en Dinamarca.
El trabajo ha sido financiado por el Ministerio de Economía, Industria y Competividad con ayuda del Fondo Europeo de Desarrollo Regional, el Instituto de Salud Carlos III-Fondo de Investigación Sanitaria (ISCIII-SGEFI / FEDER, ProteoRed), la Fundació La Marató de TV3 y la Fundación “la Caixa”.

JACC
Descubren mutaciones adquiridas en células sanguíneas que aceleran la progresión de la insuficiencia cardiaca
Una investigación realizada en el CNIC y Hospital Universitario Virgen de la Arrixaca de Murcia demuestra que la hematopoyesis clonal representa un nuevo factor de riesgo cardiovascular y un vínculo relevante entre edad y enfermedad cardiovascular.
Una persona adulta genera diariamente cientos de miles de millones de células sanguíneas. Sin embargo, este proceso necesario facilita la aparición de mutaciones en las células responsables de su producción. Dichas mutaciones se denominan somáticas porque se producen debido a cambios adquiridos, no hereditarios, en el ADN de estas células progenitoras. Y, aunque estas mutaciones son en su mayor parte inocuas, en ocasiones provocan que las células que las presentan adquieran una ventaja competitiva que permite que se expandan de forma progresiva, dando lugar a clones en la sangre, lo que conocemos como hematopoyesis clonal.
La hematopoyesis clonal está relacionada con el envejecimiento, por lo que a medida que envejecemos hay más probabilidades de que se produzca este proceso, explica el Dr. José Javier Fuster, coordinador de la investigación que se publicó en JACC.
“Estudios recientes han demostrado que los individuos con hematopoyesis clonal tienen un mayor riesgo de desarrollar cánceres hematológicos y de muerte, que, sin embargo, no está causada por la enfermedad oncológica, sino por causas cardiovasculares”, asegura el Dr. Fuster.
“Sabemos que existe una relación clara entre la hematopoyesis clonal y un mayor riesgo de desarrollar enfermedad cardiovascular aterosclerótica, la causa última de la mayoría de infartos de miocardio y de muchos ictus cerebrales”, indica el Dr. Domingo Pascual-Figal, investigador externo del CNIC y cardiólogo del Hospital Universitario Virgen de la Arrixaca de Murcia.

En este nuevo estudio, en el que también participaron las Unidades de Genómica y Bioinformática del CNIC e investigadores del Hospital Universitario Germans Trias i Pujol de Badalona, los investigadores secuenciaron el ADN genómico de células sanguíneas de un grupo de pacientes diagnosticados con insuficiencia cardiaca que fueron monitorizados durante años con el fin de detectar la presencia de hematopoyesis clonal y valorar su posible conexión con la evolución de esta enfermedad.
Los resultados, indica el Dr. Fuster, apuntan que, independientemente del origen de la insuficiencia cardiaca, “la presencia de estos clones mutantes en sangre agrava la progresión de la insuficiencia cardiaca y empeora su pronóstico”. En concreto, detalla el Dr. Pascual-Figal, “los clones con mutaciones en dos genes frecuentemente ligados a hematopoyesis clonal, TET2 y DNMT3A, se asociaron con un mayor riesgo de hospitalizaciones y muertes debidas a la propia insuficiencia cardiaca”.
Los autores concluyen que su estudio apoya la idea emergente de que “la hematopoyesis clonal representa un nuevo factor de riesgo cardiovascular y un vínculo relevante entre edad y enfermedad cardiovascular”. Además, aseguran, abren la puerta “al desarrollo de terapias personalizadas dirigidas a aquellos pacientes que presentan estas mutaciones somáticas y, con ello, prevenir la progresión de patologías muy relevantes como la insuficiencia cardiaca”.
La investigación ha sido financiada por la Beca Leonardo para Investigadores y Creadores Culturales 2019 de la Fundación BBVA, el Instituto de Salud Carlos III, el Ministerio de Ciencia e Innovación y la Fundación Séneca de Ciencia y Tecnología de la Región de Murcia. José Javier Fuster forma parte de la Red ‘Clonal hematopoiesis and atherosclerosis’, financiada por la Fundación Leducq.
JACC
Desvelan la precoz asociación entre el riesgo cardiovascular y el metabolismo cerebral
La relación entre enfermedad cardiovascular y los factores de deterioro cognitivo se produce muchos años antes de que se manifiesten los primeros síntomas clínicos de cualquiera de las dos patologías. Un estudio, llevado a cabo en el CNIC, en colaboración con el Banco Santander y expertos en neuroimagen del centro de investigación de la Fundación Pasqual Maragall, el Barcelonaβeta Brain Research Center (BBRC), demuestra que existe una asociación entre el metabolismo cerebral, el riesgo cardiovascular y la aterosclerosis durante la mediana edad, años antes de que aparezcan los primeros síntomas.
La información, que se publica en JACC, es muy relevante porque, asegura el Dr. Valentín Fuster, director general del CNIC y uno de los autores principales del estudio, abre la posibilidad de intervenir sobre un trastorno modificable, como las enfermedades cardiovasculares, para prevenir la evolución de una patología para la que no hay tratamiento, como es la demencia.
Además, los datos obtenidos en este estudio sostienen todavía más la importancia de implementar estrategias primarias de prevención cardiovascular en la mediana edad como un valioso enfoque terapéutico para retrasar o incluso detener alteraciones cerebrales que pueden contribuir a un futuro deterioro cognitivo.
Es frecuente que la enfermedad vascular y la demencia coexistan en las etapas avanzadas de ambas entidades, pero hasta ahora no se había documentado dicha asociación en las etapas más iniciales. Lo que ahora aporta el trabajo coordinado en el CNIC, dirigido por la Dra. Marta Cortés Canteli, es la constatación de que, en edades tempranas y años antes de cualquier manifestación clínica, la aterosclerosis y los factores de riesgo cardiovascular ya se asocian a un menor metabolismo en zonas cerebrales implicadas en el desarrollo de demencias, especialmente de tipo alzhéimer, en el futuro.
Utilizando técnicas de imagen avanzada de Tomografía por Emisión de Positrones (PET), los investigadores cuantificaron el metabolismo cerebral en más de 500 participantes del Estudio PESA CNIC-Santander con una edad media de 50 años y sin ningún síntoma, pero que ya tenían placas de aterosclerosis en sus arterias.
El PESA CNIC-Santander, dirigido por el Dr. Valentín Fuster, es un estudio prospectivo que incluye a más de 4.000 participantes asintomáticos de mediana edad, en los cuales se está evaluando exhaustivamente la presencia y desarrollo de aterosclerosis subclínica desde el año 2010.
“Hemos visto que un mayor riesgo cardiovascular en individuos de mediana edad, aparentemente sanos, se asociaba a un menor metabolismo cerebral en zonas parieto-temporales implicadas en funciones como la memoria espacial y semántica y distintas formas de aprendizaje”, revela la investigadora del CNIC. En este sentido, el Dr. Juan Domingo Gispert, responsable del grupo de Neuroimagen del BBRC, destaca que “las áreas cerebrales que muestran menor metabolismo en aquellos participantes con mayor riesgo vascular son las que se ven afectadas por la enfermedad de Alzheimer, por lo que estos participantes sanos podrían presentar una mayor vulnerabilidad a esta patología”.
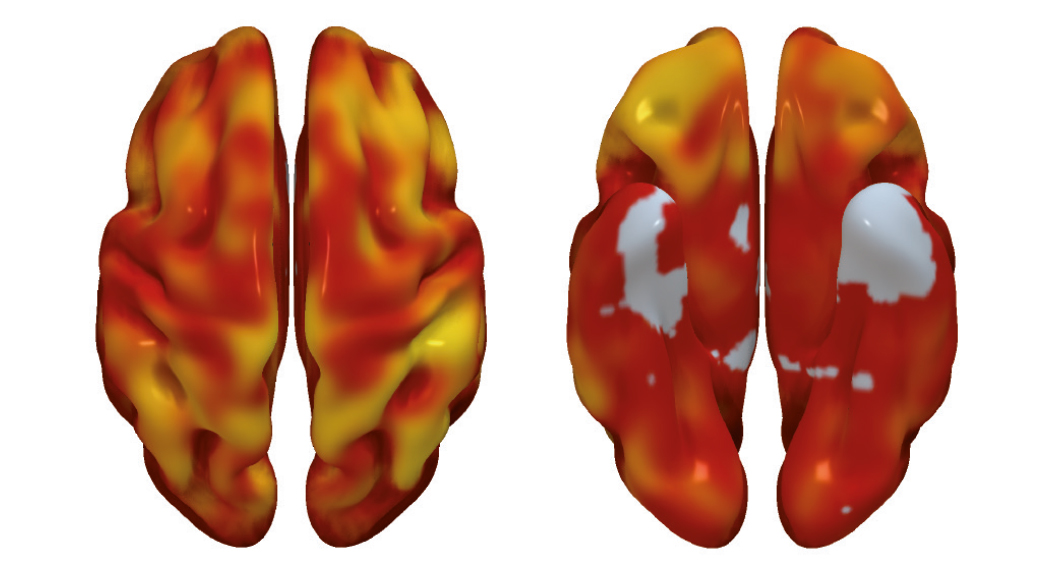
El estudio es el mayor realizado hasta la fecha en personas sanas de mediana edad y puede suponer un cambio de paradigma en la relación entre la enfermedad vascular y la cerebral, aseguran sus autores.
De entre los factores de riesgo cardiovascular modificables que están más implicados con la reducción en el metabolismo cerebral, los investigadores determinaron que la hipertensión era el más relevante. “Lo que hemos encontrado en este estudio es que los mismos factores de riesgo que dañan el corazón y las grandes arterias, y en particular la hipertensión, están íntimamente relacionados con una disminución del metabolismo cerebral años antes de la aparición de los síntomas”, indica el Dr. Fuster, uno de los autores principales del estudio.
Asimismo, los investigadores encontraron que una mayor cantidad de placa de aterosclerosis en las arterias carótidas, las encargadas de suministrar sangre al cerebro, estaba asociada a un menor metabolismo cerebral en áreas del sistema límbico y del lóbulo parietal, regiones una vez más íntimamente relacionadas con el desarrollo de la enfermedad de Alzheimer.
“El siguiente paso es investigar si estos individuos con aterosclerosis subclínica en las carótidas y un metabolismo cerebral reducido a la edad de 50 años presentan algún tipo de deterioro cognitivo 10 años después”, indica la Dra. Cortés Canteli.
Los investigadores concluyen que estos resultados suponen un importante avance en la necesidad de implementar estrategias de intervención temprana que puedan reducir la incidencia de problemas cognitivos durante la edad más avanzada.
El estudio PESA está cofinanciado a partes iguales por el CNIC y Banco Santander. Además, recibe financiación del Instituto de Salud Carlos III, Madrid, España (ISCIII, PI15/02019, PI17/00590 & PI20/00819), el Fondo Europeo de Desarrollo Regional (ERDF - A Way to Build Europe) y el Fondo Social Europeo (ESF - Investing in Your Future). El CNIC cuenta con el apoyo del ISCIII, el MCIN y la Fundación Pro-CNIC. El BBRC está financiado principalmente por Fundación “la Caixa”, EU/EFPIA Innovative Medicines Initiative Joint Undertaking EPAD, y Innovative Medicines Initiative 2 Joint Undertaking. Esta Iniciativa Conjunta recibe el apoyo del Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea y de EFPIA.
Science Advances
Descrito un nuevo mecanismo que explica cómo las células dendríticas mejoran su capacidad antiviral y de activación de la respuesta inmune
Investigadores del CNIC, liderados por el Dr. Francisco Sánchez-Madrid, desvelaron que las células dendríticas, responsables de iniciar respuestas inmunes específicas, tienen la capacidad de reprogramar sus genes, mejorando así su respuesta inmune. Los resultados de este estudio, publicado en Science Advances, pueden tener importantes aplicaciones en el desarrollo de nuevas estrategias de vacunación e inmunoterapia.
Las células dendríticas son células presentadoras de antígeno profesionales que inician la respuesta inmune adaptativa o específica. Para ello, explican los investigadores del CNIC, “estas células captan posibles agentes patogénicos en los distintos tejidos y vías de entrada, los procesan y transportan hasta los ganglios linfáticos. Allí se establece la comunicación con los linfocitos T a través de la organización de una estructura especializada, denominada ‘sinapsis inmune’, mediante la cual la célula dendrítica le ‘muestra’ a los linfocitos T diversos componentes ya procesados del agente infeccioso, para así poder ser reconocido e iniciar una respuesta inmune específica del linfocito T contra dicho agente”.
Hasta ahora, se creía que la función de estas células dendríticas estaba limitada a la activación de los linfocitos T. Sin embargo, el grupo del profesor Francisco Sánchez-Madrid, en colaboración con el de la Dra. Almudena R. Ramiro, ha descubierto que, durante la formación de la sinapsis inmune, las células dendríticas también reciben mensajes de los linfocitos T, “que las instruyen e inducen a cambiar su programa de expresión génica, aumentando la de aquellos genes relacionados con la movilidad, la respuesta antiviral y la secreción de moléculas, potenciando con ello su capacidad para generar respuestas inmunes protectoras anti-patogénicas”, señala Sánchez-Madrid.
“Este trabajo describe cómo alteraciones de la expresión genética se acompañan de cambios en las marcas epigenéticas del ADN, que, a su vez, producen variaciones transitorias en genes específicos, los cuales facilitan o dificultan su expresión”, explican Irene Fernández Delgado y Diego Calzada Fraile, principales autores del estudio. En concreto, añaden, “uno de los genes que aumentan su expresión y accesibilidad es Ccr7, un receptor de migración celular, situado en la superficie de las células dendríticas, que las dirige hacia los ganglios linfáticos”.

Los investigadores han descubierto que, tras producirse una sinapsis inmune, las células dendríticas son más “eficientes” en su migración a los ganglios linfáticos, donde se generan la mayoría de procesos para la activación de la respuesta inmune específica o adaptativa.
Este estudio, realizado en estrecha colaboración con las Unidades del CNIC de Bioinformática, dirigida por Fátima Sánchez-Cabo, y de Genómica, comandada por Ana Dopazo, describe un nuevo mecanismo que explica cómo las células dendríticas mejoran sus capacidades antivirales y de activación de la respuesta inmune.
En resumen, concluyen los investigadores, este trabajo muestra que las células dendríticas, responsables de iniciar respuestas inmunes específicas, reprograman sus genes mediante marcas epigenéticas en el ADN tras interactuar con los linfocitos T. “Dichos cambios —añaden— mejoran su capacidad migratoria de modo que llegan rápidamente a los sitios de activación de la respuesta inmune representando un nuevo mecanismo de potenciación de la respuesta inmunitaria”.
Además, la investigación puede tener importantes aplicaciones en el desarrollo de nuevos desarrollos de vacunación e inmunoterapia, ya que los mecanismos descritos podrían usarse para generar células dendríticas post-sinápticas super-migratorias, e inducir así una respuesta inmune más potente y eficaz.
El estudio ha contado con la financiación de la Fundación “la Caixa” a través de la convocatoria de ‘Proyectos de Investigación en Salud’ HR17-00016 y una beca de doctorado INPhINIT ‘Retaining’.

















