Circulation: Distintos genes modificadores determinan el efecto de dos mutaciones causantes de miocardiopatía
Un estudio del CNIC desvela que mutaciones previamente descritas en el gen MINDBOMB1 (MIB1) como causantes de miocardiopatía no compactada, provocan esta enfermedad o defectos valvulares, cuando están combinadas con mutaciones en genes modificadores
La miocardiopatía no compactada, es una patología provocada por defectos durante el desarrollo prenatal que puede tener repercusiones muy diversas en la salud de los pacientes que la sufren, llegando incluso a provocar la muerte súbita. El grupo de Señalización Intercelular durante el Desarrollo del Centro Nacional de Investigaciones Cardiovasculares (CNIC) ya descubrió que esta enfermedad podía ser causada por dos mutaciones distintas en el gen Mindbomb1 (Mib1).
Ahora, este mismo grupo, en colaboración con distintos grupos CIBER (CIBER de Enfermedades Cardiovasculares (CIBERCV) y CIBER de Bioingeniería, ha desvelado que el hecho de que haya una mutación en dicho gen no siempre conduce al desarrollo de la enfermedad por sí sola, sino que es dependiente del contexto genético y las otras mutaciones que «modifiquen» su efecto.
Los investigadores describen en un estudio publicado en Circulation cómo diversas mutaciones acompañantes de una mutación supuestamente “causal” de esta enfermedad cardíaca congénita, pueden contribuir a su severidad y a la manifestación de distintas anomalías, según se combinen entre sí en un paciente.
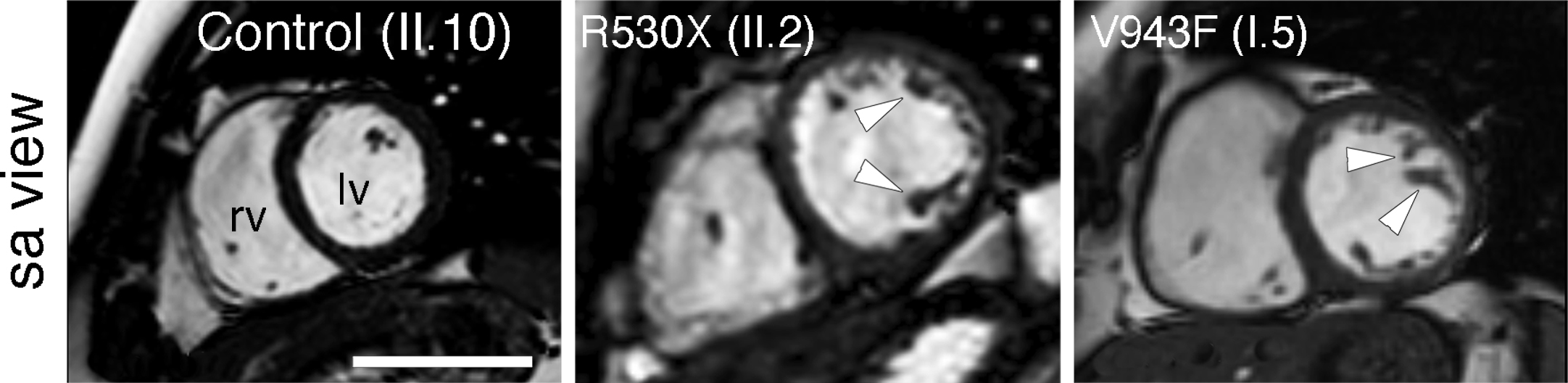
Este grupo ya había identificado en 2013 dos mutaciones en el gen Mib1 como responsables de la miocardiopatía no compactada del ventrículo izquierdo (LVNC por sus siglas en inglés) en dos familias distintas.
Defectos durante el desarrollo prenatal
Esta enfermedad, que puede tener repercusiones muy diversas en la salud de los pacientes que la sufren, llegando incluso a provocar la muerte súbita, está provocada por defectos durante el desarrollo prenatal.
A partir de este trabajo, y con el objetivo de analizar los mecanismos concretos por los que este gen es tan importante para el desarrollo correcto del corazón, este equipo liderado por el Dr. José Luis de la Pompa, introdujo dichas mutaciones en el genoma del ratón utilizando la técnica del corte y pega genético o tijeras moleculares, ‘CRISPR-Cas9’.
Usando estos modelos animales descubrieron que estos ratones mutantes padecían miocardiopatía no compactada del ventrículo izquierdo, pero únicamente si eran portadores de dos alelos mutantes para Mib1. Es decir, explica el Dr. De la Pompa, “se trataba de una situación distinta de la observada en pacientes, en los que la enfermedad se manifiesta en presencia de una única versión mutante de MIB1. Además, los ratones mostraban defectos en las válvulas cardíacas, o ambas anomalías a la vez”.
Estas diferencias, explica Marcos Siguero Álvarez, primer autor del artículo, sugerían que en los pacientes podría haber «mutaciones adicionales que contribuyesen a la severidad y diversidad de las alteraciones observadas».
Para tratar de entender qué ocurría, y gracias a la ayuda de los pacientes y sus familias y de colaboradores de diversos centros, especialmente del grupo del Dr. Juan Ramón Gimeno, del Hospital Universitario Virgen Arrixaca (Murcia), consiguieron secuenciar muestras de más miembros de la familia sanos y que padecen la enfermedad.
Los investigadores secuenciaron todo el genoma codificante (exoma) de los miembros seleccionados de las dos familias. Y como resultado de esta secuenciación, identificaron mutaciones adicionales que acompañaban a la enfermedad y a las previamente identificadas en MINDBOMB1, que afectaban a genes candidatos a contribuir al desarrollo del corazón. “Estos resultados sugerían que a la herencia de estas patologías cardíacas congénitas podían contribuir un pequeño grupo de genes (herencia oligogénica), y no uno sólo (herencia monogénica)”, detalla José Luis de la Pompa.
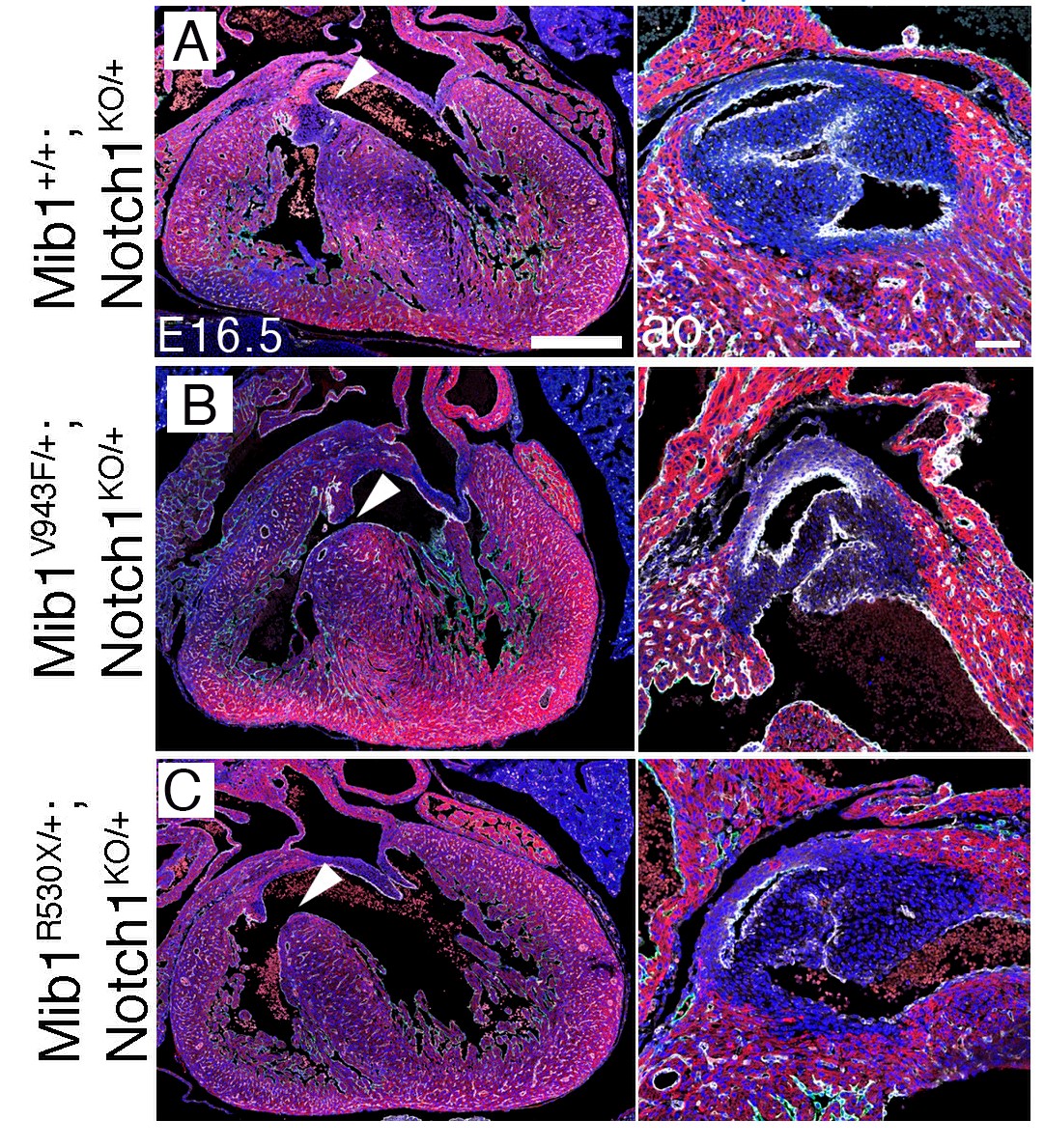
El equipo verificó estos datos usando un modelo de ratón. «La introducción del conjunto de mutaciones identificadas en una de las familias provocó defectos en el desarrollo de las cámaras cardíacas, causando LVNC y afectando a la función del corazón. Además, el otro grupo de mutaciones causó defectos valvulares a los ratones portadores, lo que mostró que estas nuevas variantes funcionaban como modificadores del efecto de la mutación en Mindbomb1», señala Marcos Siguero Álvarez.
Los investigadores destacan que de todas estas mutaciones se introdujo una única copia mutante, es decir que al igual que en los pacientes, el fenotipo se manifestaba de manera dominante.
Enfermedad congénita cardíaca no siempre es monogénica
En palabras del director de la investigación, José Luis de la Pompa, “estos descubrimientos permiten avanzar en el conocimiento de la LVNC en particular, pero también refuerzan la idea de que la enfermedad congénita cardíaca no siempre es monogénica, si no que varias mutaciones pueden intervenir en su aparición, es decir tener una herencia oligogénica”.
De esta forma, añade, “la secuenciación de nuevos genes y el estudio de las interacciones entre varias mutaciones posibles cobran, respectivamente, relevancia para avanzar en el diagnóstico de la enfermedad y para diseñar nuevos tratamientos”.
Por otra parte, los estudios in vitro con células madre diferenciadas hacia cardiomiocitos, generadas a partir de muestras de pacientes, demuestran que la miocardiopatía no compactada va asociada a un defecto en la maduración y un aumento en la proliferación de los cardiomiocitos.
Este trabajo ha sido recientemente corroborado por un estudio co-liderado por el grupo CNIC, en el que se han identificado mutaciones en el gen MINDBOMB1 humano en casos familiares y esporádicos de anomalías en la válvula aórtica (válvula aórtica bicúspide), lo cual demuestra la implicación causal de las mutaciones en MIB1 en anomalías valvulares humanas.
Este estudio ha contado con ayudas del MCIN/AEI; CIBER CV; la Fundación BBVA; la Comisión Europea (subvención H2020-HEALTH); el Consejo de Investigación Médica; la Fundación Británica del Corazón, y de la Fundació La Marató de TV3.











